Fosfán
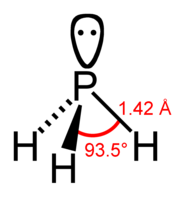
Fosfán (PH3) je hydrid fosforu. Molekula má tvar pyramídy s uhlom HPH = 93,5°. Čistý fosfán nie je samovznietivý ale v prítomnosti stôp difosfánu, P2H4, alebo pár bieleho fosforu, P4, sa vznecuje. Zapálený sa oxiduje vzduchom a môže tvoriť explózivné zmesi. Je veľmi jedovatý.
| Fosfán | |||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||||||||||||
| Sumárny vzorec | PH3 | ||||||||||||||||||||||||||||||||||||||||
| Systematický názov | Fosfán | ||||||||||||||||||||||||||||||||||||||||
| Synonymá | Fosfín | ||||||||||||||||||||||||||||||||||||||||
| Vzhľad | Bezfarebná plynná látka | ||||||||||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||||||||||||
| Molekulová hmotnosť | 34,0 u | ||||||||||||||||||||||||||||||||||||||||
| Molárna hmotnosť | 33,998 g/mol | ||||||||||||||||||||||||||||||||||||||||
| Rozpustnosť vo vode | 33 mg/100 ml (20 °C) | ||||||||||||||||||||||||||||||||||||||||
| Teplota topenia | -133,5 °C | ||||||||||||||||||||||||||||||||||||||||
| Teplota varu | -87,43 °C | ||||||||||||||||||||||||||||||||||||||||
| Kritická teplota | 51,3 °C | ||||||||||||||||||||||||||||||||||||||||
| Kritický tlak | 6 510 kPa | ||||||||||||||||||||||||||||||||||||||||
| Hustota | 0,001529 g/cm3 (0 °C) 0,746 g/cm3 (-90 °C) 0,896 g/cm3 (-135 °C) | ||||||||||||||||||||||||||||||||||||||||
| Rozpustnosť | v polárnych rozpúšťadlách: etanol dietyléter v nepolárnych rozpúšťadlách: aromatické uhľovodíky | ||||||||||||||||||||||||||||||||||||||||
| Teplota vzplanutia | 38 °C | ||||||||||||||||||||||||||||||||||||||||
| Termochemické vlastnosti | |||||||||||||||||||||||||||||||||||||||||
| Entropia topenia | 33,2 J/g | ||||||||||||||||||||||||||||||||||||||||
| Entropia varu | 429,7 J/g | ||||||||||||||||||||||||||||||||||||||||
| Štandardná zlučovacia entalpia | 9,25 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| Štandardná entropia | 210,2 J K-1 mol-1 | ||||||||||||||||||||||||||||||||||||||||
| Štandardná Gibbsová energia | 13,4 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| Merná tepelná kapacita | 1,091 J K-1 g-1 | ||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||||||||||||
| Číslo CAS | 7803-51-2 | ||||||||||||||||||||||||||||||||||||||||
| Číslo UN | 2199 | ||||||||||||||||||||||||||||||||||||||||
| EINECS číslo | 232-260-8 | ||||||||||||||||||||||||||||||||||||||||
| Číslo RTECS | SY7525000 | ||||||||||||||||||||||||||||||||||||||||
| PubChem | 24404 | ||||||||||||||||||||||||||||||||||||||||
| ChemSpider | 22814 | ||||||||||||||||||||||||||||||||||||||||
| SMILES | P | ||||||||||||||||||||||||||||||||||||||||
| 3D model (JSmol) | Interaktívny 3D model | ||||||||||||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||||||||||||

Chemické vlastnosti upraviť
Na rozdiel od amoniaku, NH3, nie je v kvapalnom stave asociovaný a je len nepatrne rozpustný vo vode. Roztoky nie sú ani kyslé ani zásadité. Reaguje však s niektorými kyselinami za vzniku fosfoniových solí:
Fosfán je tiež silným redukčným činidlom a reaguje s roztokmi mnohých kovových iónov za vzniku fosfidov. V zásaditom roztoku prebieha reakcia:
- .
Čistý plyn je bez zápachu, typický zápach technického fosfánu po rybine alebo cesnaku je spôsobený nečistotami.[1]
Toxicita upraviť
Hlavná vstupná cesta do organizmu je vdychovanie plynného fosfánu. Pri požití kovových fosfidov (najmä hliníka a zinku) dochádza v tráviacom trakte k hydrolýze a uvoľneniu fosfánu. Vdychovanie plynu spôsobuje silné podráždenie pľúc, ich edém, srdcovú dysfunkciu, excitáciu CNS, kómu, prípadne smrť. Objavujú sa tiež zažívacie ťažkosti, poškodenie obličiek a leukopénia.[1]
Po požití fosfidov sa objavuje podráždenie vedúce až ku krvácaniu, obehový kolaps, neuropsychiatrické problémy, zlyhanie dýchacích funkcií a obličiek. Neskôr sa môže objaviť poškodenie pečene. Bol publikovaný rad správ o vysokej mortalite (nad 50%) u otráv fosfidmi v Indii.[1] Fosfid zinku sa skôr používal ako rodenticíd.
K smrti pri otrave dochádza obvykle do štyroch dní, ale môže k nej dôjsť za jeden alebo dva týždne. Posmrtné analýzy ukázali infiltráciu a nekrózu srdcového svalu, pľúcny edém a poškodenie malých ciev.[1]
Chronická expozícia spôsobuje bolesti zubov, opuch až nekrózu čeľuste, slabosť, stratu váhy, anémiu a samovoľné zlomeniny.[1]
Fosfán sa z tela vylučuje jednak nezmenený vo vydychovanom vzduchu, a ďalej tiež močom v podobe fosfornanov a fosforitanov. Oxidácia fosfánu v tele je pomalá. Denaturuje oxyhemoglobín a inhibuje radu enzýmov.[1]
Boli zaznamenané prípady smrteľných otráv už pri koncentrácii fosfánu 1,2mg/m³. Pri požití fosfidu zinku nastala smrť už pri dávke 4,5g, naopak bolo hlásených prežitie i u dávky 50g.[1]
U králikov sa pri koncentrácii 70 mg/m³ po dobu 10 minút neobjavili žiadne príznaky, ale expozícia koncentrácii 140 mg/m³ bola smrteľná počas 2,5 – 3 hodín a pri koncentrácii 700 mg/m³ nastala smrť za 25 – 30 minút. Pri podávaní fosfidu zinku potkanom uhynulo 1 z 12 zvierat pri 200 mg/kg a pri 500 mg/kg 10 z 12 zvierat. Dávka 100 mg/kg a menej nebola smrteľná, ale bol pozorovaný úbytok hemoglobínu a červených krviniek.[1]
Referencie upraviť
Literatúra upraviť
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabuľky. 1. vyd. Praha : Grada Publishing, 1999. ISBN 80-7169-855-5.
Pozri aj upraviť
Zdroj upraviť
Tento článok je čiastočný alebo úplný preklad článku Fosfan na českej Wikipédii.









