Chlórmetán
Chlórmetán (taktiež: metylchlorid, monochlórmetán[2]; technické označenie: R-40, Chladivo R-40) je bezfarebná plynná organická zlúčenina mierne sladkastej vône.[1] Jedná sa o najjednoduchší halogénalkán. V minulosti sa používal ako chladivo, kvôli svojej vysokej horľavosti a obavách o jeho toxicite sa však na tieto účely už nepoužíva. Chlórmetán je taktiež súčasť cigaretového dymu.[3]
| Chlórmetán | |||||||||||||||
 | |||||||||||||||
 | |||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||
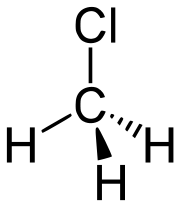
| Sumárny vzorec | CH3Cl | ||||||||||||||
| Synonymá | metylchlorid | ||||||||||||||
| Vzhľad | Bezfarebný plyn s charakteristickou vôňou. | ||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||
| Molárna hmotnosť | 50,49 g/mol | ||||||||||||||
| Teplota topenia | -97,4 °C | ||||||||||||||
| Teplota varu | -23,8 °C | ||||||||||||||
| Hustota | 1,003 g/cm3 | ||||||||||||||
| Rozpustnosť | vo vode: 0,5325 g/100 ml | ||||||||||||||
| Teplota vzplanutia | −20 °C | ||||||||||||||
| Teplota vznietenia | 625 °C | ||||||||||||||
| Medze výbušnosti | 8.1 % - 17.4 %[1] | ||||||||||||||
| |||||||||||||||
| Ďalšie informácie | |||||||||||||||
| Číslo CAS | 74-87-3 | ||||||||||||||
| Číslo UN | 1063 | ||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||
Výroba upraviť
Prvýkrát ho pripravili francúzsky chemici Jean Baptiste André Dumas a Eugène Péligot pomocou reakciou medzi kyselinou sírovou, metanolom a chloridom sodným. Väčšina chlórmetánu sa vyrába metódou podobnou akou bol pripravený prvýkrát, až na to že kyselina sírová a chlorid sodný boli nahradené za plynný chlorovodík, reakcia teda prebieha podľa nasledovnej rovnice:
Prakticky príprava prebieha pomocou jedného z dvoch spôsobov. Buď pomocou prebublávania plynného chlorovodíku cez variaci sa metanol s alebo bez ZnCl2, ktorý slúži ako katalyzátor, alebo prechodom zmesi chlorovodíku a výparov metanolu cez Al2O3, ktorý slúži ako katalyzátor pri teplote 350°C.
Takisto sa menšie množstvo pripravuje pomocou inej reakcie, kde reaguje priamo metán a chlór pri teplotách vyšších ako 400°C. Pri tejto reakcii však vznikajú aj viacnásobne chlórované vedľajšie produkty ako dichlórmetán, trichlórmetán a tetrachlórmetán a preto sa zväčša používa len v prípade, že je treba vyrobiť aj tieto látky. Pri takomto spôsobe výroby prebiehajú nasledovné reakcie:
- CH4 + Cl2 → CH3Cl + HCl
- CH3Cl + Cl2 → CH2Cl2 + HCl
- CH2Cl2 + Cl2 → CHCl3 + HCl
- CHCl3 + Cl2 → CCl4 + HCl
Chlórmetán vzniká pri prvej (vyznačenej) reakcii.
Využitie upraviť
Chlórmetán sa niekedy používal ako chladivo, kvôli svojej toxicite a horľavosti sa však na tieto účely už nepoužíva. Niekedy sa takisto používal na výrobu tetrametylolova, ktoré sa ako alternatíva k tetraetylolovu používalo ako prímes do benzínu proti detonačnému spaľovaniu. Dnes sa najčastejšie používa ako prekurzor pri výrobe silikónu a takisto ako rozpúšťadlo v ropných rafinériách a ako rozpúšťadlo pri výrobe butylových gúm. V organickej chémii sa využíva ako metylačné a chloračné činidlo. Okrem toho sa používa ako katalyzátor pri nízkoteplotných polymerizáciách, ako tekutina v teplomerných a termostatických zariadeniach a taktiež ako herbicíd.
Toxikologické informácie a bezpečnosť upraviť
- LD50: 1800 mg/kg (orálne, potkan)[2]
- LC50: 72,000 ppm (potkan, 30 min.); 2200 ppm (myš, 6 hod.); 2524 ppm (potkan, 4 hod.)[4]
Príznaky a známky otravy:
Vystavenie sa chlórmetánu môže vyvolať závrate, zmätenosť, problémy s rozprávaním a/alebo s chôdzou. Môže takisto spôsobiť ťažkosti s dýchaním. Pri vyšších koncentráciách spôsobuje paralýzu až kómu. V prípade požitia spôsobuje nevoľnosť až zvracanie. V prípade kontaktu kože so stlačeným chlórmetánom, môže dôjsť k omrzlinám. Pokiaľ sa chlórmetán dostane do očí, spôsobí rozmazané videnie a rozšírené zreničky, ktoré na svetlo reagujú len pomaly.
Dlhodobé vystavovanie sa chlórmetánu bolo spojené s vrodenými vadami u myší. U ľudí je pravdepodobné, že dlhodobé vystavovanie sa chlórmetánu v čase tehotenstva môže viesť k deformáciám chrbtice, panvy a dolných končatín plodu.
