Pyridoxalfosfát
Pyridoxalfosfát (PLP, pyridoxal-5'-fosfát, P5P) je aktívna forma vitamínu B6. Je to koenzým rôznych enzýmových reakcií. Medzinárodná únia pre biochémiu a molekulárnu biológiu zaznamenala do roku 2003 viac ako 140 PLP-dependentných aktivít, čo odpovedá asi 4 % zaznamenaných aktivít.[1] Verzatilita PLP vychádza z jeho schopnosti kovalentne viazať substrát a potom vystupovať ako elektrofilný katalyzátor, ktorý je schopný stabilizovať rôzne druhy karbaniónových reačných intermediátov.[2]
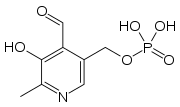
| Pyridoxalfosfát | |
 | |
 | |
| Všeobecné vlastnosti | |
| Sumárny vzorec | C8H10NO6P |
| Synonymá | Kyselina (4-formyl-5-hydroxy-6-metylpyridín-3-yl)metyldihydrogenfosforečná |
| Fyzikálne vlastnosti | |
| Molárna hmotnosť | 247,142 g/mol |
| Ďalšie informácie | |
| Číslo CAS | 54-47-7 |
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |
Úloha ako koenzým upraviť
PLP je koenzým všetkých transaminačných reakcií a takisto niektorých dekarboxylácií, deaminácií a racemizačných reakcií aminokyselín.[3] Aldehydová skupina PLP tvorí väzbu v podobe Schiffovej bázy (interný aldimín) s ε-aminoskupinou konkrétnych lyzínových reziduí v aminotransferázach. α-Aminoskupina aminokyseliny, ktorá vystupuje ako substrát, potom nahrádza ε-aminoskupinu lyzíu v aktívnom mieste. Tento proces je známy ako transaldiminácia. Výsledný externý aldimín môže odštiepiť protón, oxid uhličitý alebo aminokyselinový bočný reťazec, čím z neho vzniká chinoidový intermediát, ktorý potom môže fungovať ako nukleofil v niekoľkých reakčných dráhach.
V transaminácii po deprotonácii chinoidového intermediátu dochádza k prijatiu protónu na rôznych pozíciách, čím vzniká ketimín. Výsledný ketimín hydrolyzuje tak, že aminoskupina ostáva naviazaná na komplex.[4] Okrem toho je PLP využívaný aminotransferázami (transaminázami), ktoré prijímajú ako substrát nezvyčajné sacharidy, napríklad perozamín a dezozamín.[5] V týchto reakciách reaguje PLP s glutamátom, ktorý presúva svoju α-aminoskupinu na PLP, čím vzniká pyridoxamínfosfát (PMP). PMP potom presúva túto aminoskupinu na sacharidy, čím vznikajú aminosacharidy.
PLP sa takisto účastní rôznych β-eliminácií, napríklad reakcií katalyzovaných seríndehydratázou a GDP-4-keto-6-deoxymanóza-3-dehydratázou (ColD).[5]
PLP takisto vystupuje v kondenzačnej reakcii v syntéze hemu počas syntézy kyseliny δ-aminolevulovej.[6]
Okrem toho má PLP dôležitú úlohu pri premeno levodopy na dopamín, sprostredkováva premeni excitačného neurotransmiteru glutamátu na inhibičný neurotransmiter GABA a umožňuje dekarboxyláciu SAM za vzniku propylamínu, ktorý vystupuje ako prekurzor v syntéze polyamínov.
Úloha v ľudskom tele upraviť
Pyridoxalfosfát má v ľudsokm tele rôznorodé využitie. Medzi ne patria napríklad:
- Metabolizmus a biosyntéza serotonínu: PLP je kofaktorom dekarboxylázy aromatických L-aminokyselín. To umožňuje premeno 5-hydroxytryptofánu (5-HTP) na serotonín (5-HT). Táto reakcia prebieha v serotonergných neurónoch.
- Metabolizmus a biosyntéza histamínu: PLP je kofaktorom L-histidíndekarboxylázy. Tá katalyzuje premeno histidínu na histamín. Táto reakcia prebieha v Golgiho aparáte mastocytov a bazofilov. Histamín sa potom skladuje v zrnkách mastocytov v komplexe s kyslými reziduami heparínového proteoglykánu a v bazofiloch v komplexe s chondroitínsulfátom.
- Metabolizmus a biosyntéza GABA (kyselina γ-aminobutyrová): PLP je kofaktorom glutamátdekarboxylázy. Vďaka tomu je možná premena glutamátu na GABA. Táto reakcia prebieha v cytoplazme na koncoch GABA-ergných neurónov, takže nedostatok vitamínu B6 môže u detí spôsobovať epileptické záchvaty. PLP sa takisto účastní oxidatívnej deaminácie GABA, kde vystupuje ako kofaktor GABA aminotransferázy.
- Metabolizmus ornitínu: PLP je kofaktorom ornitíndekarboxylázy.
- Transsulfuračná cesta: PLP sa účastní i syntézy cysteínu, ktorý vzniká z metionínu.
- Transaminácia: PLP vystupuje v syntéze a rozklade aminokyselín.
Ďalšie príklady PLP upraviť
PLP sa takisto nachádza v glykogénfosforyláze v pečeni, kde pomáha pri štiepení glykogénu v glykogenolýze na základe signálu od glukagónu alebo epinefrínu. Tento enzým však nevyužíva jeho reaktívnu aldehydovú skupinu a namiesto toho na katalýzu využíva fosfátovú skupinu PLP.
Aj keď drtivá väčšina PLP-dependentných enzýmov tvorí interný aldimín s PLP pomocou lyzínového rezidua v aktívnom mieste, niektoré PLP-dependentné enzýmy toto lyzínové reziduum nemajú a namiesto neho majú na aktívnom mieste histidín. V takom prípade histidín nemôže vytvoriť interný aldimín a kvôli tomu sa tento kofaktor neviaže na enzým kovalentne. Príkladom takého enzýmu je GDP-4-keto-6-deoxymanóza-3-dehydratáza (ColD).[7] Ľudská serínhydroxymetyltransferáza 2 reguluje prenos jednouhlíkovej skupiny, ktorá je vyžadovaná na syntézu aminokyselín a metabolizmus nukleotidov, existuje v podobe diméru a tetraméru. Dimérny variant SHMT2 je potentný inhibítor BRISC deubikvitylázového enzýmového komplexu, ktorý reguluje bunkovú signalizáciu. Nedávne štúdie ukázali, že tetramerizácia SHMT2 je indukovaná PLP. Tým sa zabráni interakcii s BRISC deubikvitylázovým komplexom, čo potenciálne prepája hladinu vitamínu B6 s metabolizmom zápalov.[8]
Katalytický mechanizmus upraviť
Enzýmy využívajúce PLP (PLP enzýmy) katalyzujú mnoho rôznorodých reakcií. Aj keď rozsah týchto reakcií vyzerá byť veľmi široký, stojí za nimi tvorba interného aldimínu s lyzínom polypeptidového reťazca. Keď substrát s aminoskupinou interaguje s aktívnym miestom, dochádza k vytvoreniu Schiffovej báze, ktorá sa označuje ako externý aldimín. Po tomto kroku je mechanizmus každej reakcie odlišný.[9]
Špecificita upraviť
Špecificita je daná tým, ktorá väzba sa rozštiepi. Zo štyroch väzieb vychádzajúcich z α-uhlíku aminokyselinového aldimínu sa rozštiepi väzba kolmá na pyridínový kruh (Dunathanova stereoelektronická hypotéza).[10] Špecificita je teda daná tým, ako enzýmy viažu svoje substráty. Okrem toho hrá v špecificite úlohu i jednoduchosť protonácie pyridínového dusíka.[11]
PLP enzýmy upraviť
PLP sa drží v aktívnom mieste nielen vďaka lyzínu, ale i vďaka interakciám fosfátovej skupiny a fosfátového väzbového vrecka a do menšej miery vďaka skladaniu báz (pyridínového kruhu a aromatických reziduí, zvyčajne tyrozínu, ktorý sa niekedy účastní i axidobázickej katalýzy, poblíž). Napriek tomuto malému počtu požiadavok patria PLP enzýmy len do piatich rôznych rodín. Tieto rodiny nie vždy odpovedajú konkrétnemu typu reakcie (v rámci jednej rodiny sa teda môže vyskytovať viac rôznych reakcií a jeden typ reakcie môže byť vo viacerých rodinách). Týchto päť rodín sa značí rímskymi číslicami podľa skladby proteínu:[10]
- Typ I — rodina aspartátaminotransferázy
- Typ II — rodina tryptofánsyntázy
- Typ III — rodina alanínracemázy (TIM barel)
- Typ IV — rodina aminotransferázy D-aminokyselín
- Typ V — rodina glykogénfosforylázy
Evolúcia upraviť
PLP-dependentné enzýmy majú niekoľko evolučných pôvodov. Pôvodne sa sa PLP enzýmy delili do štyroch nezávislých evolučných línií:[2]
- α rodina (rodina aspartátaminotransferázy), ktorá je najväčšia a najlepšie preskúmaná
- β rodina (rodina seríndehydratázy)
- rodina alanínreacemázy
- rodina D-alanínaminotransferázy
Tieto rodiny však odpovedajú vyššie uvedeným typom, ku ktorým bol pridaný Typ V (ktorý, na rozdiel od ostatných, využíva fosfátovú skupinu PLP, nie aldimínový intermediát).[10] Príklad evolučnej podobnosti je však vidieť napríklad v β rodine. Všetky enzýmy, ktoré do nej patria, sú lyázy, ktoré katalyzujú reakcie, ktorých sa účastnia Cα a Cβ. Vo väčšine reakcií (okrem zmieneného typu V) sa PLP viaže kovalentou imínovou väzbou na aminoskupinu v aktívnom mieste.
Biosyntéza upraviť
Z vitamérov upraviť
Zvieratá sú auxotrofné organizmy voči tomuto kofaktoru, takže potrebujú v potrave prijímať priamo vitamín alebo intermediát v jeho syntéze, preto je PLP zaradený medzi vitamíny (ako vitamín B6), na rozdiel od napríklad MoCo alebo CoQ10. PLP sa syntetizuje z pyridoxalu pôsobením pyridoxalkinázy, ktorá v procese spotrebováva jednu molekulu ATP. PLP sa metabolizuje v pečeni.
Prototrofia upraviť
Existujú dve prírodné dráhy syntézy PLP: jedna vyžaduje deoxyxylulóza-5-fosfát (DXP) a druhá nie, takže sú známe ako DXP-dependentná a DXP-independentná. Tieto dráhy boli skúmané do detailov v E. coli (DPX-dependentná) a B. subtilis (DXP-independentná). Napriek rozdielnosti počiatočných zlúčenín a rôznemu počtu krokov majú tieto dráhy mnoho spoločného.[12]
DXP-dependentná biosyntéza upraviť
DXP-dependentná biosyntéza vyžaduje niekoľko krokov a predstavuje spojenie dvoch vetiev. V jednej vetve vzniká 3-hydroxy-1-aminoacetónfosfát z erytróza-4-fosfátu a v druhej vzniká (pôsobením jediného enzýmu) deoxyxylulóza-5-fosfát (DXP) z glyceraldehyd-3-fosfátu (GAP) a pyruvátu. Kondenzáciou 3-hydroxy-1-aminoacetónfosfátu a deoxyxylulóza-5-fosfát vzniká pyridoxín-5-fosfát. Túto kondenzáciu katalyzuje PNP syntáza, kódovaná génom pdxJ.[13] Posledným enzýmom tejto dráhy je PNP oxidáza (gén pdxH), ktorá katalyzuje oxidáciu 4' hydroxylovej skupiny na aldehyd pomocou dikyslíku. V procese vzniká peroxid vodíka.
Prvá vetva je v E. coli syntetizovaná enzýmami epd, pdxB, serC a pdxA. Tieto enzýmy majú podobné mechanizmy ako a sú homologické s troma enzýmami vystupujúcimi v biosyntéze serínu (serA (homológ pdxB), serC, serB, ale epd je homológ gap), čo poukazuje na zdieľaný evolučný pôvod týchto dráh.[14] V niekoľkých druhoch existujú dva homológy génu serC z E. coli, zvyčajne jeden v ser operóne (serC) a jeden v pdx operóne (kde sa nazýva pdxF).
Okrem toho bola náhodou objavená dráha, ktorá umožňuje potlačiť auxotrofiu, ktorá vzniká deléciou génu pdxB (ktorý kóduje erytronát-4-fosfátdehydrogenázu) v E. coli. Táto dráha je veľmi neefektívna, ale funguje vďaka promiskuitnej aktivite rôznych enzýmov. Začína 3-fosfohydroxypyruvátom (3PHP; produktom enzýmu kódovaným génom serA z biosyntézy serínu) a nevyžaduje erytronát-4-fosfát. 3PHP sa defosforyluje, čím vzniká nestabilný intermediát, ktorý sa spontánne dekarboxyluje (preto je v biosyntéze serínu prítomná fosfátová skupina) na glykolaldehyd. Glykaldehyd potom kondenzuje s glycínom a produkt sa fosforyluje za vzniku 4-fosfohydroxytreonínu (4-PHT), čo je kanonický substrát pre 4-PHT dehydrogenázu (pdxA).[15] Ak je v rastovom médiu prítomný 4-hydroxytreonín, nadexpresia enzýmu homoserínkinázy (kódovaná ThrB) môže takisto obnoviť syntézu PLP v mutantoch, ktorí nemajú pdxB.[16]
DXP-independentná biosyntéza upraviť
DXP-independentná biosyntéza PLP pozostáva z kroku, ktorý katalyzuje PLP syntáza, čo je enzým zložený z dvoch podjednotiek. Produkt pdxS katalyzuj kondenzáciu ribulóza-5-fosfátu, glyceraldehyd-3-fosfátu a amoniaku. Amoniak je produkovaný pomocou produktu pdxT z glutamínu. PdxS je (β/α)8 barel (známy i ako TIM barel), ktorá tvorí dodekamér.[17]
Abiotická syntéza upraviť
Široké využitie PLP v centrálnom metabolizme, hlavne v biosyntéze aminokyselín, a jeho aktivita v neprítomnosti enzýmov naznačujú, že PLP môže byť „prebiotická“ zlúčenina – teda že je to zlúčenina, ktorá je staršia než život sám (nezamieňať s prebiotikami, teda látkami, ktoré sa využívajú ako potrava pre baktérie s pozitívnym účinkom na ľudské zdravie).[18] Zahrievanie amoniaku a glykolaldehydu spontánne tvorí celú radu pyridínov vrátane pyridoxalu.[18] Za istých podmienok vzniká PLP z kyanoacetylénu, diacetylénu, oxidu uhoľnatého, vodíka, vody a kyseliny fosforečnej.[19]
Inhibítory upraviť
Je známych niekoľko inhibítorov PLP enzýmov.
Jeden druh inhibítorov nevratne reaguje s PLP za vzniku aduktu, ktorý je viazaný na na lyzínové reziduum v aktívnom mieste. Príkladom takýchto inhibítorov sú acetylénové zlúčeniny (napríklad propargylglycín) a vinylové zlúčeniny (napríklad vinylglycín). Ďalším druhom inhibítorov sú α-metyl a amino-oxy analógy substrátov (napríklad α-metylglutamát), ktoré reagujú za vzniku nereaktívnych aldimínov. Ďalším príkladom inhibítorov sú látky, ktoré majú dobrú odstupujúcu skupinu, ktoré potom nukleofilne atakujú PLP, medzi ktoré patrí napríklad β-chloroalanín.[10] Okrem toho existujú ďalšie druhy inhibítorov.
Medzi príklady inhibítorov patria:
- Levotyroxín – U potkanov, ktorým bolo podávaných 10 µg D,L-tyroxínu denne po dobu 15 dní, vymizla aktivita cysteíndesulfhydrylázy a aktivita seríndehydratázy, treoníndehydratázy a alanínglutamáttransaminázy sa znižila o asi 40 %. Podávanie PLP in vivo alebo prídavok PLP in vitro k modelom pečene úplne obnovilo aktivitu týchto enzýmov a potlačilo slabú inhibícia tyroxínu pri koncentrácii 10-5 M.[20][21]
- Pyridoxín – Neaktívna forma PLP, pyridoxín, pôsobí ako kompetitívny inhibítor. Kvôli tomu sa môže podávanie vitamínu B6 v podobe pyridoxínu ako potravinového doplnku prejaviť podobne, ako nedostatok vitamínu B6. Tomuto efektu možno predísť podávaním priamo aktívnej formy vitamínu, PLP.[22]
- Alanínfosfonát (AlaP) – AlaP inhibuje alanínracemázu, ale nie je dostatočne špecifický pre tento enzým, čo viedlo k ďalším dizajnom inhibítorov pre tento enzým.[23]
- Gabakulín a vigabatrín – Tieto látky inhibujú GABA aminotransferázu.
- Kanalín a 5-fluórmetylornitín – Inhibítory ornitínaminotransferázy.
- Amino-oxy SAM – Inhibuje ACC syntázu.
Referencie upraviť
- ↑ A genomic overview of pyridoxal-phosphate-dependent enzymes. EMBO Reports, September 2003, s. 850–4. DOI: 10.1038/sj.embor.embor914. PMID 12949584.
- ↑ a b From cofactor to enzymes. The molecular evolution of pyridoxal-5'-phosphate-dependent enzymes. Chemical Record, 2001, s. 436–47. DOI: 10.1002/tcr.10005. PMID 11933250.
- ↑ Coenzymes and Cofactors. New York : Wiley Interscience, 1986. ISBN 978-0471097853. Vitamin B6: Pyridoxal Phosphate.
- ↑ Reaction specificity in pyridoxal phosphate enzymes. Archives of Biochemistry and Biophysics, January 2005, s. 279–87. DOI: 10.1016/j.abb.2004.09.037. PMID 15581583.
- ↑ a b Biosynthesis of O-antigens: genes and pathways involved in nucleotide sugar precursor synthesis and O-antigen assembly. Carbohydrate Research, November 2003, s. 2503–19. DOI: 10.1016/j.carres.2003.07.009. PMID 14670712.
- ↑ LAYER, Gunhild; REICHELT, Joachim; JAHN, Dieter. Structure and function of enzymes in heme biosynthesis. Protein Science, 2010-05-24, roč. 19, čís. 6, s. 1137–1161. Dostupné online [cit. 2022-08-31]. DOI: 10.1002/pro.405. (po anglicky)
- ↑ The structure of GDP-4-keto-6-deoxy-D-mannose-3-dehydratase: a unique coenzyme B6-dependent enzyme. Protein Science, September 2006, s. 2093–106. DOI: 10.1110/ps.062328306. PMID 16943443.
- ↑ The evolving world of pseudoenzymes: proteins, prejudice and zombies. BMC Biology, November 2016, s. 98. DOI: 10.1186/s12915-016-0322-x. PMID 27835992.
- ↑ Pyridoxal Phosphate Enzymes: Mechanistic, Structural, and Evolutionary Considerations. Annual Review of Biochemistry, 2004, s. 383–415. DOI: 10.1146/annurev.biochem.73.011303.074021. PMID 15189147.
- ↑ a b c d Pyridoxal phosphate enzymes: mechanistic, structural, and evolutionary considerations. Annual Review of Biochemistry, 2004, s. 383–415. Dostupné online. DOI: 10.1146/annurev.biochem.73.011303.074021. PMID 15189147.
- ↑ Role of the pyridine nitrogen in pyridoxal 5'-phosphate catalysis: activity of three classes of PLP enzymes reconstituted with deazapyridoxal 5'-phosphate. Journal of the American Chemical Society, September 2011, s. 14823–30. Dostupné online. DOI: 10.1021/ja2061006. PMID 21827189.
- ↑ Two independent routes of de novo vitamin B6 biosynthesis: not that different after all. The Biochemical Journal, October 2007, s. 1–13. DOI: 10.1042/BJ20070765. PMID 17822383.
- ↑ Recent progress of vitamin B6 biosynthesis. Journal of Nutritional Science and Vitaminology, April 2004, s. 69–77. DOI: 10.3177/jnsv.50.69. PMID 15242009.
- ↑ Metabolic relationships between pyridoxine (vitamin B6) and serine biosynthesis in Escherichia coli K-12. Journal of Bacteriology, November 1990, s. 6518–28. DOI: 10.1128/jb.172.11.6518-6528.1990. PMID 2121717.
- ↑ Three serendipitous pathways in E. coli can bypass a block in pyridoxal-5'-phosphate synthesis. Molecular Systems Biology, November 2010, s. 436. DOI: 10.1038/msb.2010.88. PMID 21119630.
- ↑ COPLEY, Shelley D.; NEWTON, Matilda S.; WIDNEY, Karl A.. How to Recruit a Promiscuous Enzyme to Serve a New Function. Biochemistry, 2022-06-21, s. acs.biochem.2c00249. Dostupné online [cit. 2022-08-30]. ISSN 0006-2960. DOI: 10.1021/acs.biochem.2c00249. (po anglicky)
- ↑ A new arrangement of (beta/alpha)8 barrels in the synthase subunit of PLP synthase. The Journal of Biological Chemistry, July 2005, s. 27914–23. DOI: 10.1074/jbc.M503642200. PMID 15911615.
- ↑ a b Prebiotic synthesis of vitamin B6-type compounds. Origins of Life and Evolution of the Biosphere, May 1999, s. 287–96. DOI: 10.1023/A:1006532518221. PMID 10389266.
- ↑ A plausible prebiotic synthesis of pyridoxal phosphate: vitamin B6 - a computational study. Biophysical Chemistry, September 2006, s. 113–21. DOI: 10.1016/j.bpc.2006.04.014. PMID 16730878.
- ↑ Inhibition by Thyroxine of Enzymes requiring Pyridoxal-5-Phosphate. Nature, 1957, s. 968. DOI: 10.1038/179968a0. PMID 13430754.
- ↑ Biochemical Actions of Thyroid Hormones. Physiological Reviews, 1962, s. 605–673. DOI: 10.1152/physrev.1962.42.4.605. PMID 13954890.
- ↑ The vitamin B6 paradox: Supplementation with high concentrations of pyridoxine leads to decreased vitamin B6 function. Toxicology in Vitro, 2017, s. 206–212. DOI: 10.1016/j.tiv.2017.07.009. PMID 28716455.
- ↑ New classes of alanine racemase inhibitors identified by high-throughput screening show antimicrobial activity against Mycobacterium tuberculosis. PLOS ONE, 2011, s. e20374. DOI: 10.1371/journal.pone.0020374. PMID 21637807.
Pozri aj upraviť
Zdroj upraviť
Tento článok je čiastočný alebo úplný preklad článku Pyridoxal phosphate na anglickej Wikipédii.