Enolát
Enoláty alebo enolátové anióny sú organické anióny, ktorých všeobecný vzorec je R1R2C=CR3-O-.[1] Vznikajú deprotonáciou karbonylových zlúčenín (R1R2C=O) alebo enolov (R1R2C=CR3-OH). Málokedy je možné ich izolovať, ale často sa používajú ako reagenty v syntéze organických zlúčenín.[2][3][4][5]
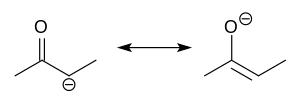
Štruktúra
upraviťEnoláty sú elektronicky príbuzné alylovým aniónov. Záporný náboj je delokalizovaný medzi atómom kyslíka a dvomi atómami uhlíka. Majú teda charakter alkoxidu i karbaniónu.[6]
Aj keď sa často zakresľujú ako jednoduché soli, v skutočnosti majú komplikované štruktúry a často tvoria agregáty.
Referencie
upraviť- ↑ organické anióny. In: BÍNA, Jaroslav. Malá encyklopédia chémie. Bratislava : Obzor, 1981. S. 495.
- ↑ STOLZ, Daniel; KAZMAIER, Uli. PATai's Chemistry of Functional Groups. [s.l.] : [s.n.], 2010. ISBN 9780470682531. DOI:10.1002/9780470682531.pat0423 Metal Enolates as Synthons in Organic Chemistry.
- ↑ The ester enolate-imine condensation route to .beta.-lactams. Chemical Reviews, 1989, s. 1447–1465. DOI: 10.1021/cr00097a003.
- ↑ Organolithium Reagents in Pharmaceutical Asymmetric Processes. Chemical Reviews, 2006, s. 2596–2616. DOI: 10.1021/cr040694k. PMID 16836294.
- ↑ New Developments of the Principle of Vinylogy as Applied to π-Extended Enolate-Type Donor Systems. Chemical Reviews, 2020, s. 2448–2612. DOI: 10.1021/acs.chemrev.9b00481. PMID 32040305.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "Enolates". DOI:10.1351/goldbook.E02123
Zdroj
upraviťTento článok je čiastočný alebo úplný preklad článku Enolate na anglickej Wikipédii.