Dvojitá väzba
Dvojitá väzba v chémii označuje kovalentnú väzbu medzi dvoma atómami, ktorej sa účastnia štyri väzbové elektróny, na rozdiel od jednoduchej väzby, ktorej sa účastnia len dva elektróny. Dvojité väzby sa bežne nachádzajú medzi dvoma uhlíkovými atómami, napríklad v alkénoch. Mnohé dvojité väzby existujú i medzi dvoma rôznymi atómami: napríklad v karbonylovej skupine medzi kyslíkom a uhlíkom. Ďalšie bežné dvojité väzby sa nachádzajú v azozlúčeninách (N=N), imínoch (C=N) a sulfoxidoch (S=O). V chemických vzorcoch sa dvojitá väzba zakresľuje dvomi rovnobežnými čiarami medzi dvoma atómami. Typograficky sa potom používa znak „rovná sa“.[1][2] Dvojitú väzbu prvýkrát použil v chemickom zápise ruský chemik Alexander Butlerov.[chýba zdroj]
Dvojité väzby, ktorých sa účastní uhlík, sú silnejšie a kratšie, než jednoduché väzby. Väzbový poriadok je dva. Dvojité väzby sú takisto bohaté na elektróny, čo ich robí potenciálne reaktívnejšie v prítomnosti silných akceptorov elektrónov, ako je to napríklad pri adičných reakciách halogénov.
- Chemické zlúčeniny s dvojitými väzbami
-
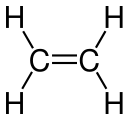
Etylén obsahuje dvojitú väzbu uhlík-uhlík
-
Acetón obsahuje dvojitú väzbu uhlík-kyslík
-
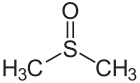
Dimetylsulfoxid obsahuje dvojitú väzbu síra-kyslík
-
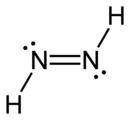
Diazén obsahuje dvojitú väzbu dusík-dusík
Dvojité väzby v alkénoch upraviť
Dvojité väzby je možné vysvetliť pomocou hybridizácie orbitálov. U etylénu má každý uhlík tri sp2 orbitály a jeden p-orbitál. Tri sp2 orbitály ležia v rovine s približne 120° uhlami. Posledný orbitál, p-orbitál, je kolmý na túto rovinu. Keď sa priblížia dva uhlíkové atómy, dva z ich sp2 orbitálov sa prekryjú (jeden od každého uhlíka), čím vznikne sigma väzba. V tom istom momente sa priblížia p-orbitály (takisto v rovnakej rovine) a vytvoria pí väzbu. Pre maximálny prekryv musia p-orbitály ostať rovnobežné, preto nie je možná rotácia okolo väzby v strede medzi týmito atómami. Na základe toho vzniká cis-trans izoméria. Dvojitá väzba je kratšia než jednoduchá väzba, čím sa maximalizuje prekryv p-orbitálov.
-
Dva sp2 orbitály sa priblížia, čím vznikne sp2-sp2 sigma väzba. Každý atóm uhlíka má ešte ďalšie dva sp2 orbitály, ktoré sú na obrázku znázornené klinmi, naviazané na vodíkové atómy.
-
Dva p-orbitály sa prekrývajú, čím vzniká pí väzba v rovine rovnobežnej so sigma rovinou.
-
Pí väzba (zelená) v etyléne.
Dĺžka väzby C=C v etyléne je 134 pm a je teda kratšia než väzby C-C v etáne, ktorej dĺžka je 154 pm. Dvojitá väzba je takisto silnejšia, s energiou 636 kJ/mol oproti 368 kJ/mol, ale nie je dvakrát taká silná, pretože pí väzba je slabšia než sigma väzba kvôli menej efektívnemu pí prekryvu.
V alternatívnej reprezentácii je dvojitá väzba tvorená dvoma prekrývajúcimi sa sp3 orbitálmi, podobne ako u ohnutej väzby.[3]
Variácie upraviť
V molekulách so striedajúcimi sa dvojitými a jednoduchými väzbami môže existovať prekryv p-orbitálov medzi viacerými atómami v reťazci, čím vzniká konjugovaný systém. Konjugácia sa nachádza napríklad v diénoch a enónoch. V cyklických molekulách môže konjugácia viesť k aromaticite. V prípade kumulénov sú dvojité väzby hneď na tom istom atóme.
Dvojité väzby sú bežné pre prvky druhej periódy, konkrétne pre uhlík, dusík a kyslík. U prvkov ostatných periód sa vyskytujú málokedy. Kovy môžu takisto tvoriť násobné väzby s ligandmi.
Homológy alkénov v 14. skupine upraviť
Homológy alkénov, teda zlúčeniny s dvojitou väzbou, R2E=ER2, sú známe pre všetky ťažšie prvky 14. skupiny. Na rozdiel od alkénov nie sú tieto zlúčeniny planárne, ale majú skrútené alebo ohnuté trans štruktúry. Tento efekt je výraznejší pri ťažších prvkoch. Distanén (Me3Si)2CHSn=SnCH(SiMe3)2 obsahuje dvojitú väzbu cín-cín, ktorá je len o niečo málo kratšia oproti jednoduchej väzbe a má ohnutú trans štruktúru s pyramidálnou koordináciou na každom atóme cínu. Ľahko sa disociuje na (Me3Si)2CHSn: (stanéndiyl, analóg karbénu). Väzba pozostáva z dvoch slabých koordinačných väzieb, kde sa voľný elektrónový pár každého atómu cínu prekrýva s prázdnym p-orbitálom toho druhého.[4][5] Naproti tomu v prípade disilénov má každý atóm kremíka planárnu koordináciu, ale jednotlivé substituenty sú skrútené, takže molekula ako taká nie je planárna. V diplumbénoch môže byť väzba Pb=Pb dlhšia, než mnohé jednoduché väzby podobných zlúčenín.[5] Plumbény a stanény zvyčajne disociujú na monoméry s väzbovými entalpiami malmi v porovnaní s podobnými jednoduchými väzbami. Niektoré dvojité väzby v plumbénoch a stanénoch sú podobne silné ako vodíkové väzby.[4] Na predpovedanie povahy väzby je možné použiť Carter-Goddard-Malrieu-Trinquier model.[4]
Typy dvojitých väzieb medzi atómami upraviť
Pre zlúčeniny s dvojitými väzbami sa používajú rôzne názvy podľa toho, ktoré atómy sa väzby účastnia:
| C | O | N | S | Si | Ge | Sn | Pb | |
|---|---|---|---|---|---|---|---|---|
| C | alkén | karbonylová skupina | imín | tioketón, tiál | ||||
| O | dikyslík | nitrózozlúčenina | sulfoxid, sulfón, sulfínová kyselina, sulfónová kyselina | |||||
| N | azozlúčenina | |||||||
| S | disíra | |||||||
| Si | alkylidénsilán | silén | ||||||
| Ge | germén | |||||||
| Sn | stannén | |||||||
| Pb | plumbén |
Referencie upraviť
- ↑ MARCH, JERRY, 1929-1997.. Advanced organic chemistry : reactions, mechanisms, and structure. 3rd. vyd. New York : Wiley, 1985. Dostupné online. ISBN 0-471-88841-9.
- ↑ MCMURRY, JOHN. Organic chemistry. Ninth. vyd. Boston, MA, USA : [s.n.]. Dostupné online. ISBN 978-1-305-08048-5.
- ↑ CAREY, FRANCIS A., 1937-. Advanced organic chemistry. 5th. vyd. New York : Springer, 2007. Dostupné online. ISBN 978-0-387-44897-8.
- ↑ a b c POWER, Philip P.. π-Bonding and the Lone Pair Effect in Multiple Bonds between Heavier Main Group Elements. Chemical Reviews, 1999, s. 3463–3504. DOI: 10.1021/cr9408989. PMID 11849028.
- ↑ a b Unique homonuclear multiple bonding in main group compounds. Chemical Communications (Royal Society of Chemistry), 2009, s. 5201–5213. DOI: 10.1039/B908048A. PMID 19707626.
Literatúra upraviť
- Triple-Bond Covalent Radii. Chemistry: A European Journal, 2005, s. 3511–20. DOI: 10.1002/chem.200401299. PMID 15832398.
Zdroj upraviť
Tento článok je čiastočný alebo úplný preklad článku Double bond na anglickej Wikipédii.