Amyloid beta
Amyloid beta, nazývaný aj amyloid beta peptid, β-amyloid, amyloid Β, Abeta, Aβ alebo AP, je druh peptidov, ktoré majú dĺžku 36–43 aminokyselín a tvoria hlavnú zložky amyloidových plakov v mozgoch ľudí s Alzheimerovou chorobou.[2][3] Tieto peptidy vznikajú z amyloidového prekurzorového proteínu (APP), ktorý je štiepený beta sekretázou a gama sekretázou, čím vzniká Aβ, pričom tento proces je závislý na cholesterole a predstavuje substrátovú prezentáciu (aktivácia enzýmov po vystavení substrátu).[4] Molekuly Aβ môžu agregovať a tak tvoriť flexibilné rozpustné oligoméry, ktoré existujú v rôznych podobách. Aktuálne sa predpokladá, že niektoré nesprávne poskladané oligoméry (známe ako semienka, po anglicky seeds) spôsobujú nesprávne poskladanie ostatných molekúl Aβ, čo vedie k reťazovej reakcii podobnej priónovej infekcii. Tieto oligoméry sú toxické pre nervové bunky.[5] Druhý proteín, ktorý podľa všetkého súvisí s Alzheimerovou chorobou, tau proteín, taktiež tvorí nesprávne poskladané oligoméry podobné priónom a existujú aj dôkazy, že nesprávne poskladaný Aβ spôsobuje nesprávne poskladanie tau proteínu.[6][7]
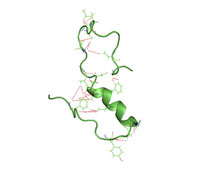 Čiastočne poskladaná štruktúra amyloidu beta (1-40) vo vodnom prostredí (PDB 2LFM)[1] | |
| Identifikátory | |
|---|---|
| Pfam | PF03494 |
| InterPro | IPR013803 |
| SCOP2 | 2lfm / SCOPe / SUPFAM |
| OPM superrodina | 304 |
| OPM proteín | 2Y3K |
| TCDB | 1.C.50 |
V jednej štúdii bolo navrhnuté, že APP a jeho amyloidový potenciál je starovekého pôvodu a potenciálne sa nachádzal už u raných druhoústovcov.[8]
Normálna funkcia
upraviťNormálna funkcia Aβ nie je známa.[9] Napriek tomu, že niektoré štúdie na zvieratách ukázali, že absencia Aβ nevedie k strate žiadnej očividnej fyziologickej funkcie,[10][11] bolo objavených niekoľko potenciálnych aktivít Aβ, vrátane aktivácie kináz,[12][13] obrane proti oxidačnému stresu,[14][15] regulácie prenosu cholesterolu,[16][17] funkcie ako transkripčného faktoru[18][19] a antimikrobiálnej aktivity (potenciálne asociovanej s prozápalovou aktivitou).[20][21][22]
Glymfatický systém je zodpovedný za vylučovanie metabolického odpadu, hlavne Aβ, z cicavčieho mozgu.[23] Pomocou genetických a biochemických štúdií bolo odhalených niekoľko proteáz, ktoré sú zodpovedné za rozoznávanie a rozklad Aβ; medzi tieto proteázy patria inzulín rozkladajúci enzým[24] a presekvenčná proteáza.[25] Rýchlosť odstraňovania sa výrazne zvyšuje počas spánku.[26] Rozsah a význam glymfatického systému v odstraňovaní Aβ u Alzheimerovej choroby však nie je známy.[27]
Spojenie s chorobami
upraviťAβ je hlavná zložka amyloidových plakov, čo sú mimobunkové nánosy, ktoré sa nachádzajú v mozgu ľudí s Alzheimerovou chorobou.[28] Aβ môže taktiež tvoriť nánosy, ktoré lemujú mozgové cievy u cerebrálnej amyloidovej angiopatie. Plaky sa skladajú zo zapletených oligomérov Aβ[29] a pravidelne usporiadaných agregátov označovaných ako amyloidové fibrily,[30] čo je proteínový fold, ktorý majú aj iné peptidy, napríklad prióny spájané s chorobou nesprávne poskladaných proteínov, známu ako proteínopatia.
Alzheimerova choroba
upraviťPodľa výskumu by rozpustné oligomérne formy Aβ boli byť dôvod vzniku a rozvoja Alzheimerovej choroby.[31] Všeobecne sa predpokladá, že oligoméry Aβ sú najtoxickejšie.[32] Niekoľko štúdií z genetiky, bunkovej biológie a biochémie a zvieracích štúdií s použitím experimentálnych modelov podporilo teóriu, že Aβ hrá hlavnú úlohu vo vývoji patológie Alzheimerovej choroby.[33][34]
Hladina Aβ v mozgu je zvýšená u ľudí so sporadickou Alzheimerovou chorobou. Aβ je hlavná zložka mozgových parenchymálneho a vaskulárneho amyloidu; prispieva k cerebrovaskulárnym léziám a je neurotoxický.[33][34][35] Nie je jasné, ako sa Aβ ukladá v centrálnom nervovom systéme a následne vzniká choroba buniek. Na odhalenie mechanizmov zodpovedných za tvorbu Aβ, vrátane proteolytických beta a gama sekretázy, ktoré tvoria Aβ z APP, bolo vynaložené veľké úsilie.[36][37] Aβ obieha v plazme, mozgomiechovom moku a mozgovom tkanivovom moku hlavne v podobe rozpustného Aβ40.[33][38] Amyloidové plaky sa skladajú z Aβ40 a Aβ42,[39] zatiaľ čo vaskulárne amyloidy sa skladajú hlavne z kratšieho Aβ40. V oboch druhoch lézií bolo nájdených niekoľko sekvencií Aβ.[40][41]
Predpokladá sa, že zvýšenie celkovej hladiny Aβ alebo relatívnej koncentrácie Aβ40 i Aβ42 (pričom Aβ40 je zastúpenejší v cerebrovaskulárnych plakoch a Aβ42 v neuritických plakoch)[42] hrá úlohu v patogenéze familiárnej i sporadickej Alzheimerovej choroby. Keďže je hydrofóbnejší, Aβ42 tvorí amyloidy zo všetkých Aβ najviac. Je však známe, že centrálna sekvencia (KLVFFAE) tvorí amyloidy i osamote a pravdepodobne tvorí jadro fibríl.[chýba zdroj] Podľa jednej štúdie koreluje hladina Aβ42 v mozgu nielen s nástupom Alzheimerovej choroby, ale i so zníženým tlakom mozgomiechového moku, čo naznačuje, že nánosy alebo nedostatočné odstraňovanie fragmentov Aβ42 hrajú úlohu v patológii choroby.[43]
Amyloidová hypotéza – teória, že plaky sú zodpovedné za patológiu Alzheimerovej choroby – je prijímaná väčšinou výskumníkov, ale nie je jednoznačne zavedená. Alternatívnou hypotézou je, že za chorobu sú zodpovedné amyloidové oligoméry a nie plaky.[32][44]
Rakovina
upraviťPredpokladá sa, že Aβ sa objavuje i vývoja rakoviny, čo viedlo k štúdiám mnohých druhov rakovín, aby sa zistila povaha jeho možných účinkov, ale výsledky sú prevažne nepresvedčivé. Hladina Aβ bola zmeraná u mnohých karcinómov, vrátane karcinómu pažeráku, pľúc a pečeňe či kolorektálneho karcinómu, pretože u pacientov, ktorí tieto karcinómy prekonali, bolo pozorované nižšie riziko vzniku Alzheimerovej choroby. U všetkých karcinómov bola hladina Aβ zvýšená, hlavne u karcinómov pečene.[45] Nebolo však ustanovené, ktoré je zodpovedné za čo. Štúdie zamerané na bunkové línie ľudskej rakoviny prsníka taktiež ukázali, tieto rakovinové bunky vykazujú zvýšenú expresiu amyloidového prekurzorového proteínu (APP).[46]
Downov syndróm
upraviťU dospelých s Downovým syndrómom bolo ukladanie amyloidov spojené s dôkazmi Alzheimerovej choroby, vrátane zhoršenia kognitívnych funkcií, pamäte, jemnej motoriky, exekutívnych funkcií a vizuospaciálnych zručností.[47]
Referencie
upraviť- ↑ A partially folded structure of amyloid-beta(1-40) in an aqueous environment. Biochemical and Biophysical Research Communications, July 2011, s. 312–6. DOI: 10.1016/j.bbrc.2011.06.133. PMID 21726530.
- ↑ The amyloid beta peptide: a chemist's perspective. Role in Alzheimer's and fibrillization. Chemical Reviews, October 2012, s. 5147–92. Dostupné online. DOI: 10.1021/cr3000994. PMID 22813427.
- ↑ Rehabilitácia zlého amyloidu | Unilabs [online]. www.unilabs.sk, [cit. 2024-07-17]. Dostupné online.
- ↑ Regulation of beta-amyloid production in neurons by astrocyte-derived cholesterol. Proceedings of the National Academy of Sciences of the United States of America, August 2021, s. e2102191118. DOI: 10.1073/pnas.2102191118. PMID 34385305.
- ↑ Soluble protein oligomers in neurodegeneration: lessons from the Alzheimer's amyloid beta-peptide. Nature Reviews. Molecular Cell Biology, February 2007, s. 101–12. DOI: 10.1038/nrm2101. PMID 17245412.
- ↑ Alzheimer disease: a tale of two prions. Prion, Jan–Feb 2013, s. 14–9. DOI: 10.4161/pri.22118. PMID 22965142.
- ↑ Ubiquitous amyloids. Applied Biochemistry and Biotechnology, April 2012, s. 1626–43. DOI: 10.1007/s12010-012-9549-3. PMID 22350870.
- ↑ Origins of amyloid-β. BMC Genomics, April 2013, s. 290. DOI: 10.1186/1471-2164-14-290. PMID 23627794.
- ↑ Functional roles of amyloid-beta protein precursor and amyloid-beta peptides: evidence from experimental studies. Journal of Alzheimer's Disease, 2009, s. 401–12. DOI: 10.3233/JAD-2009-1154. PMID 19584429.
- ↑ Beta-amyloid exhibits antagonistic effects on alpha 7 nicotinic acetylcholine receptors in orchestrated manner. Journal of Medical Hypotheses and Ideas, 2014, s. 48–52. DOI: 10.1016/j.jmhi.2014.01.001.
- ↑ BACE1 (beta-secretase) knockout mice do not acquire compensatory gene expression changes or develop neural lesions over time. Neurobiology of Disease, October 2003, s. 81–8. DOI: 10.1016/S0969-9961(03)00104-9. PMID 13678669.
- ↑ Targeting the JNK MAPK cascade for inhibition: basic science and therapeutic potential. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics, March 2004, s. 89–101. DOI: 10.1016/j.bbapap.2003.11.016. PMID 15023353.
- ↑ Signaling effect of amyloid-beta(42) on the processing of AβPP. Experimental Neurology, January 2010, s. 18–25. DOI: 10.1016/j.expneurol.2009.09.002. PMID 19747481.
- ↑ A novel function of monomeric amyloid beta-protein serving as an antioxidant molecule against metal-induced oxidative damage. The Journal of Neuroscience, June 2002, s. 4833–41. DOI: 10.1523/JNEUROSCI.22-12-04833.2002. PMID 12077180.
- ↑ Abeta40, either soluble or aggregated, is a remarkably potent antioxidant in cell-free oxidative systems. Biochemistry, May 2009, s. 4354–70. DOI: 10.1021/bi802361k. PMID 19320465.
- ↑ Function of beta-amyloid in cholesterol transport: a lead to neurotoxicity. FASEB Journal, October 2002, s. 1677–9. DOI: 10.1096/fj.02-0285fje. PMID 12206998.
- ↑ Amyloid beta-protein stimulates trafficking of cholesterol and caveolin-1 from the plasma membrane to the Golgi complex in mouse primary astrocytes. Neuroscience, August 2009, s. 328–38. DOI: 10.1016/j.neuroscience.2009.04.049. PMID 19401218.
- ↑ The Alzheimer's amyloid β-peptide (Aβ) binds a specific DNA Aβ-interacting domain (AβID) in the APP, BACE1, and APOE promoters in a sequence-specific manner: characterizing a new regulatory motif. Gene, November 2011, s. 1–12. DOI: 10.1016/j.gene.2011.06.004. PMID 21699964.
- ↑ Functional activity of the novel Alzheimer's amyloid β-peptide interacting domain (AβID) in the APP and BACE1 promoter sequences and implications in activating apoptotic genes and in amyloidogenesis. Gene, November 2011, s. 13–22. DOI: 10.1016/j.gene.2011.06.017. PMID 21708232.
- ↑ Antimicrobial properties of amyloid peptides. Molecular Pharmaceutics, April 2012, s. 708–17. DOI: 10.1021/mp200419b. PMID 22081976.
- ↑ Antimicrobial peptides in the brain: neuropeptides and amyloid. Frontiers in Bioscience, June 2012, s. 1375–80. DOI: 10.2741/S339. PMID 22652879.
- ↑ Amyloid, tau, pathogen infection and antimicrobial protection in Alzheimer's disease -conformist, nonconformist, and realistic prospects for AD pathogenesis. Translational Neurodegeneration, 2018, s. 34. DOI: 10.1186/s40035-018-0139-3. PMID 30603085.
- ↑ A paravascular pathway facilitates CSF flow through the brain parenchyma and the clearance of interstitial solutes, including amyloid β. Science Translational Medicine, August 2012, s. 147ra111. DOI: 10.1126/scitranslmed.3003748. PMID 22896675.
- ↑ Structures of human insulin-degrading enzyme reveal a new substrate recognition mechanism. Nature, October 2006, s. 870–4. DOI: 10.1038/nature05143. PMID 17051221.
- ↑ Molecular basis of substrate recognition and degradation by human presequence protease. Structure, July 2014, s. 996–1007. DOI: 10.1016/j.str.2014.05.003. PMID 24931469.
- ↑ Sleep drives metabolite clearance from the adult brain. Science, October 2013, s. 373–7. DOI: 10.1126/science.1241224. PMID 24136970.
- ↑ Clearance systems in the brain-implications for Alzheimer disease. Nature Reviews. Neurology, August 2015, s. 457–70. DOI: 10.1038/nrneurol.2015.119. PMID 26195256.
- ↑ Amyloid-beta: a crucial factor in Alzheimer's disease. Medical Principles and Practice, 2014, s. 1–10. DOI: 10.1159/000369101. PMID 25471398.
- ↑ Label-free vibrational imaging of different Aβ plaque types in Alzheimer's disease reveals sequential events in plaque development. Acta Neuropathologica Communications, December 2020, s. 222. DOI: 10.1186/s40478-020-01091-5. PMID 33308303.
- ↑ Assembly of β-Amyloid Aggregates at the Molecular Level. Chemtracts-Organic Chemistry, 2000, s. 51–56.
- ↑ Amyloid-beta protein dimers isolated directly from Alzheimer's brains impair synaptic plasticity and memory. Nature Medicine, August 2008, s. 837–42. DOI: 10.1038/nm1782. PMID 18568035.
- ↑ a b The toxicity of amyloid β oligomers. International Journal of Molecular Sciences, 2012, s. 7303–27. DOI: 10.3390/ijms13067303. PMID 22837695.
- ↑ a b c Amyloidosis and Alzheimer's disease. Advanced Drug Delivery Reviews, December 2002, s. 1539–51. DOI: 10.1016/S0169-409X(02)00149-7. PMID 12453671.
- ↑ a b Clearing the brain's amyloid cobwebs. Neuron, October 2001, s. 177–80. DOI: 10.1016/S0896-6273(01)00475-5. PMID 11683988.
- ↑ Genetic dissection of Alzheimer's disease and related dementias: amyloid and its relationship to tau. Nature Neuroscience, September 1998, s. 355–8. DOI: 10.1038/1565. PMID 10196523.
- ↑ Beta-secretase cleavage of Alzheimer's amyloid precursor protein by the transmembrane aspartic protease BACE. Science, October 1999, s. 735–41. Dostupné online. DOI: 10.1126/science.286.5440.735. PMID 10531052.
- ↑ Beta-secretase (BACE) as a drug target for Alzheimer's disease. Advanced Drug Delivery Reviews, December 2002, s. 1589–602. DOI: 10.1016/S0169-409X(02)00157-6. PMID 12453676.
- ↑ Transport-clearance hypothesis for Alzheimer's disease and potential therapeutic implications. [s.l.] : Landes Bioscience, 2003. Dostupné online. S. 114–122.
- ↑ Amyloid plaque core protein in Alzheimer disease and Down syndrome. Proceedings of the National Academy of Sciences of the United States of America, June 1985, s. 4245–9. DOI: 10.1073/pnas.82.12.4245. PMID 3159021.
- ↑ The length of amyloid-beta in hereditary cerebral hemorrhage with amyloidosis, Dutch type. Implications for the role of amyloid-beta 1-42 in Alzheimer's disease. The Journal of Biological Chemistry, December 1996, s. 32185–91. DOI: 10.1074/jbc.271.50.32185. PMID 8943274.
- ↑ beta-Amyloid-(1-42) is a major component of cerebrovascular amyloid deposits: implications for the pathology of Alzheimer disease. Proceedings of the National Academy of Sciences of the United States of America, November 1993, s. 10836–40. DOI: 10.1073/pnas.90.22.10836. PMID 8248178.
- ↑ Soluble amyloid beta peptide concentration as a predictor of synaptic change in Alzheimer's disease. The American Journal of Pathology, September 1999, s. 853–62. DOI: 10.1016/S0002-9440(10)65184-X. PMID 10487842.
- ↑ Levels of amyloid-beta-42 and CSF pressure are directly related in patients with Alzheimer's disease. Journal of Neural Transmission, December 2017, s. 1621–1625. DOI: 10.1007/s00702-017-1786-8. PMID 28866757.
- ↑ Common structure of soluble amyloid oligomers implies common mechanism of pathogenesis. Science, April 2003, s. 486–9. DOI: 10.1126/science.1079469. PMID 12702875.
- ↑ Plasma Amyloid-Beta Levels in Patients with Different Types of Cancer. Neurotoxicity Research, February 2017, s. 283–288. DOI: 10.1007/s12640-016-9682-9. PMID 27913965.
- ↑ Amyloid-β precursor protein promotes cell proliferation and motility of advanced breast cancer. BMC Cancer, December 2014, s. 928. DOI: 10.1186/1471-2407-14-928. PMID 25491510.
- ↑ Cognitive decline and brain amyloid-β accumulation across 3 years in adults with Down syndrome. Neurobiology of Aging, October 2017, s. 68–76. DOI: 10.1016/j.neurobiolaging.2017.05.019. PMID 28715661.
Zdroj
upraviťTento článok je čiastočný alebo úplný preklad článku Amyloid beta na anglickej Wikipédii.