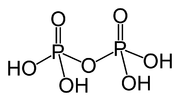
Kyselina difosforečná
Kyselina difosforečná alebo kyselina pyrofosforečná je anorganická zlúčenina. Je to bezfarebná kvapalina bez zápachu, ktorá je rozpustná vo vode, dietyléteri a etanole. Kryštalizuje v dvoch polymorfoch, ktoré sa topia pri teplotách 54,3 a 71,5 °C. Takisto je súčasťou kyseliny polyfosforečnej, ktorá je dôležitým zdrojom kyseliny fosforečnej.[1] Formálne je to anhydrid kyseliny fosforečnej. Anióny (konjugované zásady), soli a estery kyseliny difosforečnej sa nazývajú difosforečnany, difosfáty alebo pyrofosfáty.
| Kyselina difosforečná | |
 | |
 | |
| Všeobecné vlastnosti | |
| Sumárny vzorec | H4P2O7 |
| Synonymá | μ-Oxido-bis(dihydroxidooxidofosfor) |
| Fyzikálne vlastnosti | |
| Molárna hmotnosť | 177,97 g/mol |
| Ďalšie informácie | |
| Číslo CAS | 2466-09-3 |
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |
Príprava
upraviťKyselinu difosforečnú možno pripraviť reakciou kyseliny fosforečnej s fosforylchloridom:[2]
- 5 H3PO4 + POCl3 → 3 H4P2O7 + 3 HCl
Takisto sa dá pripraviť výmenou iónov z pyrofosforečnanu sodného alebo pôsobením sulfánu na pyrofosforečnan olovnatý.[1]
Reakcie
upraviťPri zahriatí na vysoké teploty vzniká rovnováha medzi kyselinami fosforečnou, difosforečnou a polyfosforečnou. Asi 40 % (hmotnostných) zmesi tvorí kyselina difosforečná a je zložité ju z tejto zmesi rekryštalizovať.
Aj keď je rozpustná v studenej vode, kyselina difosforečná hydrolyzuje, podobne ako všetky polyfosforečné kyseliny:[3]
- H4P2O7 + H2O ↔ 2 H3PO4
Kyselina difosforečná je stredne silná anorganická kyselina.
Bezpečnosť
upraviťKyselina difosforečná je žieravá, ale inak nie je známa žiadna iná jej toxicita.[4]
História
upraviťNázov kyselina pyrofosforečná jej dal „Mr. Clarke z Glasgowa“ v roku 1827, ktorý je uvedený ako jej objaviteľ, ktorý ju získal po zahriatí fosforečnanu sodného do červena. Bolo zistené, že kyselina fosforečná po zahratí do červena tvorí kyselinu difosforečnú, ktorá sa v teplej vode ľahko mení naspäť na kyselinu fosforečnú.[5]
Referencie
upraviť- ↑ a b HAVELANGE, Sébastien; LIERDE, Nicolas; GERMEAU, Alain. Ullmann's Encyclopedia of Industrial Chemistry. [s.l.] : [s.n.], 2022. ISBN 9783527303854. DOI:10.1002/14356007.a19_465.pub4 Phosphoric Acid and Phosphates, s. 1–55.
- ↑ R. Klement. Handbook of Preparative Inorganic Chemistry, 2nd Ed.. Ed. G. Brauer. NY,NY : Academic Press, 1963. Condensed Orthophosphates, s. 546.
- ↑ CORBRIDGE, D.. Studies in inorganic Chemistry vol. 20. [s.l.] : Elsevier Science B.V., 1995. ISBN 0-444-89307-5. DOI:10.1016/B978-0-444-89307-9.50008-8 Chapter 3: Phosphates, s. 169–305.
- ↑ Material Safety Data Sheet: Pyrophosphoric acid MSDS Archivované 2016-03-03 na Wayback Machine www.sciencelab.com
- ↑ BECK, Lewis Caleb. A Manual of Chemistry: Containing a Condensed View of the Present State of the Science, with Copious References to More Extensive Treatises, Original Papers, Etc. [s.l.] : E.W & C Skinner, 1834. Dostupné online. S. 160.
Pozri aj
upraviťZdroj
upraviťTento článok je čiastočný alebo úplný preklad článku Pyrophosphoric acid na anglickej Wikipédii.