trp operón
Tryptofánový operón, skrátene trp operón, je operón – skupina génov, ktoré sa využívajú alebo transkribujú naraz – ktorý kóduje jednotlivé zložky potrebné pre produkciu tryptofánu. Tryptofánový operón je prítomný u mnohých baktérií, ale prvýkrat bol opísaný u baktérie Escherichia coli. Pokiaľ je tryptofán prítomný v okolí, neexprimujú sa gény tohto operónu potrebné pre jeho syntézu. Tento operón bol veľmi dôležitým experimentálnym systémom pri skúmaní génovej regulácie a bežne sa využíva na jej vysvetlenie.
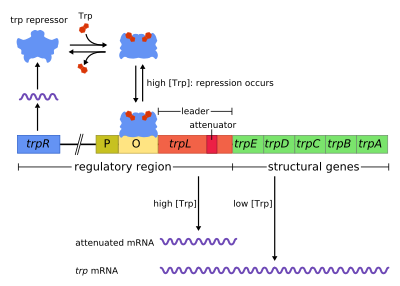
Tryptofánový operón obsahuje päť štruktúrnych génov – trpE, trpD, trpC, trpB a trpA – ktoré kódujú enzýmy tejto metabolickej dráhy. Okrem toho obsahuje i represívny regulačný gén, trpR. Tento regulačný gén má promótor, kam sa viaže RNA polymeráza, ktorá syntetizuje mRNA pre regulačný proteín. Proteín sa následne viaže na operátor, čím znemožňuje transkripciu. V trp operóne sa tryptofán viaže na represorový proteín, čím sa blokuje transkripcia génov. Ide teda o represiu pomocou blokovania RNA polymerázy, ktorá nemôže prepisovať gény v operóne. Narozdiel od lac operónu má trp operón ešte vedúci proteín a atenuátor, ktoré umožňujú stupňovanú reguláciu.[1]
Tryptofánový operón je príkladov reprimovateľnej negatívnej regulácie génovej expresie. Represorový proteín sa viaže na operátor v regulačnej sekvencii tohto operónu, ak je prítomný tryptofán, čím sa znemožní transkripcia. Represorový proteín sa naopak uvoľní, ak je tryptofán nedostupný, čím sa transkripcia povolí.
Gény operónu
upraviťTryptofánový operón obsahuje päť štruktúrnych génov:[2]
- trpE, trpD: Podjednotky antranilátsyntázy, ktorá premieňa chorizmát na antranilát. Antranilát sa potom ďalej mení na N-(5-fosfo-β-D-ribozyl)antranilát pomocou antranilát fosforibozyltransferázovej domény.
- trpC: Fosforibozylantranilátizomerázová doména najprv premení N-(5-fosfo-β-D-ribozyl)antranilát na 1-(2-karboxyfenylamino)-1-deoxy-D-ribulóza-5-fosfát. Indol-3-glycerolfosfátsyntázová doména, ktorá je prítomná v tom istom proteíne, následne premení tento produkt na (1S,2R)-1-C-(indol-3-yl)glycerol-3-fosfát.
- trpA, trpB: Podjednotky tryptofánsyntetázy. Z produktu tvoreného trpC a serínu tvorí tryptofán.
Represia
upraviťOperón využíva mechanizmus negatívnej reprimovateľnej spätnej väzby. Represor tohto operónu je produkovaný génom trpR, nachádzajúcim sa upstream od operónu (pred operónom), ktorý je stále produkovaný v malom množstve. Nasyntetizované trpR monoméry následne tvoria diméry. Keď je tryptofán prítomný, viaže sa na tieto diméry, čo spôsobuje zmenu konformácie represoru, na základe čoho sa represor môže viazať na operátor trp operónu.[2][3][4] Týmto sa zabráni väzbe RNA polymerázy na operón a prepisu génov, takže sa tryptofán neprodukuje. V prítomnosti tryptofánu totiž nie je nutné produkovať ďalší tryptofán, takže jeho prítomnosť zastaví jeho syntézu. Ak tryptofán nie je prítomný, neaktívny represor sa nedokáže viazať na operátor, takže prepis génov nie je inhibovaný.
Represor trpR riadi expresiu minimálne štyroch ďalsích génov, ktoré sa týkajú syntézy tryptofánu – okrem trp operónu (trpO) riadi i expresiu génov trpR (vznik seba samého), aroH a aroL (súčasť šikimátovej dráhy) a mtr (permeáza špecifická pre tryptofán).[4]
Atenuácia
upraviťAtenuácia (útlm, zoslabenie) je druhým mechanizmom negatívnej spätnej väzby prítomným v trp operóne. Zatiaľ čo represorový systém funguje na základe intracelulárnej koncentrácie tryptofánu, atenuácia je spojená s koncentráciou aktivovanej tRNAtrp.[5] Represor teda znižuje expresiu génov na základe zmeny počiatku transkripcie, zatiaľ čo atenuácia ovplyvňuje proces transkripcie, ktorá už začala.[5] Represor znižuje transkripciu až 70x a atenuácia ju môže znížiť ešte 10x, čo znamená celkové možné zníženie asi 700x.[6] Atenuácia je možná vďaka tomu, že u prokaryotov (ktoré nemajú bunkové jadro) prebieha translácia mRNA už počas toho, ako RNA polymeráza transkribuje DNA sekvenciu operónu. Tento proces umožňuje translácii priamo ovplyvniť transkripciu operónu.
Na začiatku trp operónu existuje sekvencia aspoň 130 nukleotidov, ktorá sa nazýva vedúci transkript.[7] Lee a Yanofsky v roku 1977 zistili, že účinnosť atenuácie súvisí so stabilitou sekundárnej štrukúry trpL.[8] Tieto dve vlásenky, ktoré tvoria terminátorové štruktúry, boli neskôr objasnené Oxenderom et al. v roku 1979.[9] Vedúci transkript obsahuje štyri krátke sekvencie, označované postupne 1-4. Káždá z týchto sekvencií je vždy čiastočne komplementárna so sekvenciou, ktorá nasleduje po nej. Na základe toho teda dochádza k tvorbe troch rôznych sekundárnych štruktúr (vláseniek): 1–2, 2–3 alebo3–4. Hybridizácia sekvencií 1 a 2, ktorá vedie k tvorbe štruktúry 1–2, je vzácna, pretože RNA polymeráza čaká na naviazanie ribozómu, než pokračuje v transkripcii za sekvenciou 1. Ak sa však táto štruktúra vytvorí, znemožní tvorbu štruktúry 2–3 (ale nie 3–4). Tvorba vlásenky zo sekvencií 2 a 3 potom znemožňuje tvorbu ostatných vláseniek, teda 1–2 aj 3–4. Štruktúra 3–4 je takzvaná transkripčná terminačná sekvencia, ktorá obsahuje veľa G/C a hneď za nimi nasleduje niekoľko uracilových reziduí. Keď sa vytvorí táto štruktúra, RNA polymeráza disociuje z DNA a transkripcia štruktúrnych génov operónu je ukončená (pozri nižšie). Pri experimentoch s destabilizáciou G+C párovania druhej vlásenky, tvorenej sekvenciami 3 a 4, bola pozorovaná znížená frekvencia transkripčnej terminácie, čo preukazuje dôležitosť druhej vlásenky pre funkciu transkripčnej terminácie.[8][10][11][12]
Časť vedúceho transkriptu kóduje krátky polypeptid tvorený 14 aminokyselinami, ktorý sa nazýva aj vedúci peptid. Tento peptid obsahuje dve po sebe idúce tryptofánové reziduá, čo je nezvyčajné, vzhľadom na to, že tryptofán je celkom neobvyklou aminokyselinou (bežný proteín z E. coli je tvorený tryptofánom z asi 1%). Sekvencia 1 v trpL zahŕňa región, ktorý postupne obsahuje reziduá Trp, Trp, Arg, Thr a Ser.[5] Týchto päť reziduí je vysoko konzervovaných (zachovaných naprieč rôznymi druhmi baktérií), zatiaľ čo mutácie v oblasti pred touto sekvenciou (upstream) nevedú k zmene expresie operónu.[5][13][14][15] Keď ribozóm príde k tejto časti sekvencie a koncentrácia tryptofánu je nízka, zastaví sa na niektorom z kodónov Trp. Keď zastaví, fyzicky bráni sekvencii 1 transkriptu viazať sa na sekvenciu 2, takže blokuje tvorbu štruktúry 1–2. Sekvencia 2 sa potom môže voľne viazať na sekvenciu 3 a tvoriť štruktúru 2–3, ktorá zase zabraňuje tvorbe štruktúry 3–4 (terminačnej vlásenky). Preto sa štruktúra 2–3 občas nazýva antiterminačnou vlásenkou. V prítomnosti štruktúry 2–3 môže RNA polymeráza naďalej pokračovať v transkripcii operónu. Štúdie a analýzy pomocou mutácií, ktoré využívali komplementárne oligonukleotidy, ukázali, že stabilita štruktúry 2–3 odpovedá úrovni expresie operónu.[13][16][17][18] Ak je koncentrácia tryptofánu v bunke vysoká, ribozóm preloží celý vedúci peptid bez prerušenia a zastaví sa len pri terminácii translácii na stop kodóne. V tomto prípade ribozóm zaberá sekvencie 1 a 2, čo umožňuje tvorbu štruktúry 3–4, ktorá ukončí transkripciu. Táto terminačná štruktúra sa tvorí v prípade, že sa ribozóm nezastaví pri kodónoch Trp alebo Arg: buď sa nepreložil vedúci peptid, alebo translácia pokračuje bez problémov s dostatkom aktivovaných tRNAtrp.[5][13] Ribozóm blokuje len asi 10 nukleotidov dopredu (downstream), takže ak sa ribozóm zastaví pri inom kodóne, evidentne neovplyvňuje tvorbu terminačnej vlásenky.[5][13] Výsledkom je, že operón sa prepisuje len v prípade, že je tryptofán nedostupný pre ribozómy, zatiaľ čo trpL transkript sa stále exprimuje.
Tento atenuačný mechanizmus je experimentálne podložený niekoľkými štúdiami. Bolo priamo ukázané, že translácia vedúceho peptidu a zastavenie ribozómu sú nutné predpoklady pre inhibíciu transkripčnej terminácie.[16] Mutačná analýza destabilizujúca alebo narúšajúca párovanie báz antiterminačnej vlásenky ukázala niekoľkonásobne zvýšenú frekvenciu terminácie – toto je konzistentné s atenuačným modelom, pretože táto mutácia spôsobuje nadmernú termináciu i v prípade neprítomnosti Trp.[13][16] Naproti tomu oligonukleotidy komplementárne so sekvenciou 1 zvyšujú expresiu operónu, nakoľko podporujú tvorbu antiterminačnej vlásenky.[13][17] U histidínového operónu bolo ukázané, že schopnosť párovania sekvencií 2 a 3 je dôležitejšia pri znížení atenuácie, než ich primárna sekvencia.[13][18]
Poloha, v ktorej sa ribozóm zastaví, určuje, či sa vytvorí terminačná vlásenka alebo nie.[13] Aby mohla polymeráza rozpoznať alternatívnu štruktúru, rýchlosť štruktúrnej modulácie musí byť porovnateľná s rýchlosťou transkripcie. Aby bolo zariadené, že sa ribozóm ihneď naviaže a začne prekladať vedúci tanskript hneď po jeho syntéze polymerázou, existuje v trpL špeciálna sekvencia, kde polymeráza zastaví. Až sa k nej RNA polymeráza dostane, zastaví sa a evidentne čaká na to, kým začne translácia. Tento mechanizmus umožňuje synchronizáciu transkripcie a translácie, čo je dôležité pre správnu funkciu atenuácie.
Podobný atenuačný mechanizmus reguluje i syntézu histidínu, fenylalanínu, treonínu či rozvetvených aminokyselín.[2]
Regulácia trp operónu v Bacillus subtilis
upraviťGény trp operónu Bacillus subtilis sú usporiadané rovnako, ako v prípade E. coli.[19] Regulácia trp operónu je v oboch organizmoch závislá na hladine tryptofánu v bunke. Narozdiel od E. coli je však u B. subtilis atenuácia hlavným spôsobom regulácie biosyntézy tryptofánu namiesto represie.[20] U B. subtilis sa tryptofán viaže na atenuačný proteín, TRAP (RNA-viažuci atenuačný proteín aktivovaný tryptofánom), ktorý sa následne viaže na RNA.[21][22] Tento proteín má 11 podjednotiek. Väzba tryptofánom aktivovaného TRAP na vedúcu sekvenciu RNA vedie k tvorbe terminačnej štruktúry, čo vedie k ukončeniu transkripcie.[20]
Referencie
upraviť- ↑ KLUG, William S; CUMMINGS, Michael R; SPENCER, Charlotte. Concepts of Genetics. 8th. vyd. New Jersey : Pearson Education Inc, 2006. ISBN 978-0-13-191833-7. S. 394–402.
- ↑ a b c VOET, Donald. Biochemistry. 4th ed. Hoboken, NJ : John Wiley & Sons, 2011. ISBN 978-0-470-57095-1. S. 1296 – 1299.
- ↑ SANTILLÁN, Moisés; MACKEY, Michael C.. Dynamic regulation of the tryptophan operon: A modeling study and comparison with experimental data. Proceedings of the National Academy of Sciences of the United States of America, 2001-02-13, roč. 98, čís. 4, s. 1364–1369. PMID: 11171956 PMCID: PMC29262. Dostupné online [cit. 2024-01-09]. ISSN 0027-8424.
- ↑ a b JASEJA, Mahesh; JEEVES, Mark; HYDE, Eva I.. Trp Repressor−Operator Binding: NMR and Electrophoretic Mobility Shift Studies of the Effect of DNA Sequence and Corepressor Binding on Two Trp Repressor−Operator Complexes. Biochemistry, 2002-12-01, roč. 41, čís. 50, s. 14866–14878. Dostupné online [cit. 2024-01-09]. ISSN 0006-2960. DOI: 10.1021/bi020072y. (po anglicky)
- ↑ a b c d e f Attenuation in the control of expression of bacterial operons. Nature, February 1981, s. 751–8. DOI: 10.1038/289751a0. PMID 7007895.
- ↑ LEHNINGER, Albert L.; NELSON, David L.; COX, Michael M.. Principles of Biochemistry. 5th. vyd. New York, NY : W.H. Freeman and Company, 2008. Dostupné online. ISBN 978-0-7167-7108-1. S. 1128.
- ↑ Transcription termination in vivo in the leader region of the tryptophan operon of Escherichia coli. Journal of Molecular Biology, May 1976, s. 319–37. DOI: 10.1016/0022-2836(76)90315-6. PMID 781269.
- ↑ a b Transcription termination at the trp operon attenuators of Escherichia coli and Salmonella typhimurium: RNA secondary structure and regulation of termination. Proceedings of the National Academy of Sciences of the United States of America, October 1977, s. 4365–9. DOI: 10.1073/pnas.74.10.4365. PMID 337297.
- ↑ Attenuation in the Escherichia coli tryptophan operon: role of RNA secondary structure involving the tryptophan codon region. Proceedings of the National Academy of Sciences of the United States of America, November 1979, s. 5524–8. DOI: 10.1073/pnas.76.11.5524. PMID 118451.
- ↑ Transcript secondary structures regulate transcription termination at the attenuator of S. marcescens tryptophan operon. Nature, July 1982, s. 34–8. DOI: 10.1038/298034a0. PMID 7045685.
- ↑ Escherichia coli tryptophan operon leader mutations, which relieve transcription termination, are cis-dominant to trp leader mutations, which increase transcription termination. Journal of Molecular Biology, September 1980, s. 123–9. DOI: 10.1016/0022-2836(80)90210-7. PMID 6159477.
- ↑ Single base-pair alterations in the Escherichia coli trp operon leader region that relieve transcription termination at the trp attenuator. Proceedings of the National Academy of Sciences of the United States of America, October 1978, s. 4833–7. DOI: 10.1073/pnas.75.10.4833. PMID 368800.
- ↑ a b c d e f g h Attenuation in amino acid biosynthetic operons. Annual Review of Genetics, 1982, s. 113–34. DOI: 10.1146/annurev.ge.16.120182.000553. PMID 6186194.
- ↑ Comparison of the nucleotide sequences of the initial transcribed regions of the tryptophan operons of Escherichia coli and Salmonella typhimurium. Journal of Molecular Biology, May 1978, s. 193–217. DOI: 10.1016/s0022-2836(78)80005-9. PMID 351195.
- ↑ Naturally occurring promoter down mutation: nucleotide sequence of the trp promoter/operator/leader region of Shigella dysenteriae 16. Proceedings of the National Academy of Sciences of the United States of America, November 1978, s. 5580–4. DOI: 10.1073/pnas.75.11.5580. PMID 364484.
- ↑ a b c Translational control of transcription termination at the attenuator of the Escherichia coli tryptophan operon. Proceedings of the National Academy of Sciences of the United States of America, December 1978, s. 5988–92. DOI: 10.1073/pnas.75.12.5988. PMID 366606.
- ↑ a b Transcription termination at the tryptophan operon attenuator is decreased in vitro by an oligomer complementary to a segment of the leader transcript. Proceedings of the National Academy of Sciences of the United States of America, April 1982, s. 2181–5. DOI: 10.1073/pnas.79.7.2181. PMID 6179092.
- ↑ a b DNA sequence changes of mutations altering attenuation control of the histidine operon of Salmonella typhimurium. Journal of Molecular Biology, February 1981, s. 735–56. DOI: 10.1016/0022-2836(81)90312-0. PMID 6167727.
- ↑ Evolution of bacterial trp operons and their regulation. Current Opinion in Microbiology, April 2008, s. 78–86. DOI: 10.1016/j.mib.2008.02.005. PMID 18374625.
- ↑ a b Complexity in regulation of tryptophan biosynthesis in Bacillus subtilis. Annual Review of Genetics, 2005-11-14, s. 47–68. DOI: 10.1146/annurev.genet.39.073003.093745. PMID 16285852.
- ↑ The mechanism of RNA binding to TRAP: initiation and cooperative interactions. RNA, January 2001, s. 85–93. DOI: 10.1017/S135583820100173X. PMID 11214184.
- ↑ The structure of trp RNA-binding attenuation protein. Nature, April 1995, s. 693–700. Dostupné online. DOI: 10.1038/374693a0. PMID 7715723.
Zdroj
upraviťTento článok je čiastočný alebo úplný preklad článku trp operon na anglickej Wikipédii.