Transaminácia
Transaminácia je chemická reakcia, pri ktorej dochádza k presunu aminoskupiny na ketokyselinu, čím vzniká nová aminokyselina. Vďaka transaminačným reakciám dochádza k deaminácii väčšiny aminokyselín.[1] Je to jedna z hlavných degradačných dráh, ktorá premieňa esenciálne aminokyseliny na neesenciálne aminokyseliny (aminokyseliny, ktoré môžu byť organizmom syntetizované de novo).
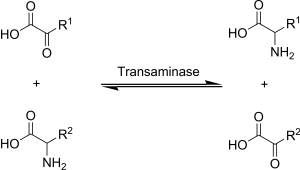
Transamináciu v biochémii vykonávajú enzýmy známe ako transaminázy alebo aminotransferázy. Hlavným akceptorom aminoskupiny je α-ketoglutarát, z ktorého vzniká glutamát:[1]
- aminokyselina + α-ketoglutarát ↔ α-ketokyselina + glutamát
Aminoskupina glutamátu sa potom presúva na oxalacetát v druhej transaminačnej reakcii, čím vzniká aspartát:[1]
- glutamát + oxalacetát ↔ α-ketoglutarát + aspartát
Mechanizmus reakcie upraviť
Transaminácia katalyzovaná aminotransferázami prebieha v dvoch krokoch. V prvom kroku sa α-aminoskupina prenesie na enzým, čím vzniká príslušná α-ketokyselina a amínovaný enzým. V druhom kroku sa aminoskupina prenesie na akceptorovú ketokyselinu, čím vzniká aminokyselina a obnoví sa pôvodný enzým.[1] Chiralita aminokyseliny sa určuje počas transaminácie. Aby mohla táto reakcia prebehnúť, aminotransferázy vyžadujú prítomnosť koenzýmu s aldehydovou skupinou, pyridoxal-5'-fosfátu (PLP), derivátu pyridoxínu (vitamínu B6).[1] Počas reakcie sa PLP mení na pyridoxamín-5'-fosfát (PMP), čo umožňuje väzbu aminoskupiny. PLP je kovalentne naviazaný na enzým v podobe Schiffovej bázy, ktorá vzniká kondenzáciou aldehydovej skupiny s ε-aminoskupinou lyzínu v enzýme.[1]
Ping-pongový mechanizmus PLP dependentných enzýmov, ktoré katalyzujú transamináciu.[1] Aminotransferázová reakcia prebieha v štádiách, ktoré sa skladajú z troch krokov: transaminácie, tautomerizácie a hydrolýzy. V prvom kroku sa α-aminoskupina aminokyseliny prenesie na PLP za vzniku α-ketokyseliny a PMP. V druhom štádiu reakcie sa aminoskupina prenesie z PMP na inú α-ketokyselinu za vzniku PLP a novej α-aminokyseliny.
Produkt transaminačnej reakcie závisí na dostupných α-ketokyselinách. Zvyčajne sa tvoria alanín (z pyruvátu), aspartát (z oxalacetátu) alebo glutamát (z α-ketoglutarátu), keďže príslušné α-ketokyseliny sa tvoria v metabolizme.
Alternatívny mechanizmus upraviť
Druhým typom transaminačnej reakcie je nukleofilná substitúcia amínu alebo amidového iónu na amín alebo amónnu soľ.[2] Napríklad pri ataku primárneho amidového aniónu na primárny amín vznikajú sekundárne amínu:
- RNH2 + R'NH− → RR'NH + NH2−
Symetrické sekundárne amíny sa dajú pripraviť pomocou Raneyho nikla (2RNH2 → R2NH + NH3). Kvartérne amónne soli môžu byť dealkylované etanolamínom:
- R4N+ + NH2CH2CH2OH → R3N + RN+H2CH2CH2OH
Aminonaftalény takisto podstupujú transamináciu.[3]
Druhy aminotransferáz upraviť
Transaminácia je katalyzovaná niekoľkými druhmi aminotransferáz. Tie môžu byť špecifické pre konkrétne aminokyseliny, alebo môžu prijímať ako substrát skupinu chemicky podobných aminokyselín. Druhý typy sa aplikuje na rozvetvené aminokyseliny, teda leucín, izoleucín a valín. Dve bežné aminotransferázy sú alanínaminotransferáza (ALT) a aspartátaminotransferáza (AST).
Referencie upraviť
- ↑ a b c d e f g VOET, Donald. Biochemistry. Hoboken, NJ : John Wiley & Sons, 2011. (4th edition.) Dostupné online. ISBN 978-0-470-57095-1.
- ↑ BOOTH, Gerald. Ullmann's Encyclopedia of Industrial Chemistry. [s.l.] : Wiley-VCH Verlag GmbH & Co. KGaA, 2000-01-01. ISBN 9783527306732. DOI:10.1002/14356007.a17_009 Naphthalene Derivatives.
- ↑ BOOTH, Gerald. Naphthalene Derivatives. Weinheim, Germany : Wiley-VCH Verlag GmbH & Co. KGaA, 2000-06-15. DOI: 10.1002/14356007.a17_009. Dostupné online. ISBN 978-3-527-30673-2. DOI:10.1002/14356007.a17_009 S. a17_009. (po anglicky)
Pozri aj upraviť
Zdroj upraviť
Tento článok je čiastočný alebo úplný preklad článku Transamination na anglickej Wikipédii.