Énamín
Énamín je nenasýtená organická zlúčenina, ktorá má aminoskupinu naviazanú vedľa dvojitej väzby.[1] Vznikajú napríklad kondeznáciou aldehydu alebo ketónu s amínmi (zvyčajne sekundárnymi).[2][3] Énamíny sú verzatilné intermediáty v chemickej syntéze.[1][4][5]

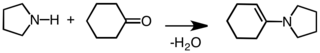
Vznik énamínu prostredníctvom kondenzácie amínu a ketónu.[6]
Názov „énamín“ pochádza z prípony -én, ktorou sa označujú alkény, a slova amín. Pôvod slova je teda podobný ako v prípade enolov, ktoré obsahujú alkén (-én) a hydroxylovú skupinu (-ol). Énamíny teda možno považovať za dusíkové analógy enolov.[7]
Ak je aspoň jeden zo substituentov na dusíkovom atóme vodík, tak môže daný énamín podliehať tautomerizácii za vzniku imínu. Podobne ako pri keto-enol tautomérii, énamíny zvyčajne tautomerizujú na imíny, aj keď existuje niekoľko výnimiek (napríklad anilín). Énamín-imín tautomériu možno pokladať za analogickú ku keto-enol tautomérii. V oboch prípadoch sa vodík presúva z heteroatómu (dusíka alebo kyslíka) na druhý uhlíkový atóm. K tautomérii nedochádza, ak énamín obsahuje sekundárny amín.[1]
Énamíny sú dobré nukleofily i dobré zásady. Ich chovanie ako uhlíkaté nukleofily možno vysvetliť pomocou rezonančných štruktúr:
Vznik upraviť
Énamíny sú labilné a teda chemicky užitočné skupiny, ktoré možno ľahko vytvoriť z komerčne dostupných činidiel. Bežný spôsob výroby énamínov spočíva v kysle katalyzovaných reakciách ketónov[8] alebo aldehydov,[9] ktoré obsahujú alfa vodík, so sekundárnymi amínmi. Kyslá katalýza nie je nutná, ak je pKaH reagujúceho amínu dostatočne vysoké (napríklad pri reakcii s pyrolidínom, ktorý má pKaH 11,26). Ak je pKaH amínu nízke, tak je potrebné použiť katalýzu kyselinou na adíciu i dehydratáciu[10] (medzi bežné dehydratačné činidlá patrí MgSO4 a Na2SO4).[11] Primárne amíny sa na syntézu énamínov zvyčajne nepoužívajú, pretože zvyčajne dochádza k termodynamicky výhodnej tautomerizácii na príslušný imín.[12] Metylketóny kondenzujú sami so sebou,čomu však možno zabrániť pridaním TiCl4[13] do reakčnej zmesi (TiCl4 vychytáva vodu).[14][15] Nižšie je príklad reakcie aldehydu so sekundárnym amínom, z ktorých vzniká najprv karbinolamín a potom po dehydratácii énamín:
Reaktivita upraviť
Énamíny sú nukleofily, ktoré nevyžadujú aktiváciu zásadou či kyselinou v takej miere, ako ich enolátové analógy. Takisto majú väčšiu selektivitu a vykazujú menej bočných reakcií. Reaktivita ketónových énamínov (vznikajúcich z ketónov) je vyššia než reaktivita aldehydových énamínov (vznikajúcich z aldehydov).[16] V prípade cyklických ketónových énamínov je päťčlenný kruh najreaktívnejší, pretože jeho priestorové usporiadanie najlepšie umožňuje konjugáciu voľného elektrónového páru s dvojitou väzbou. Reaktivita kruhov klesá v poradí 5 > 8 > 6 > 7, pričom sedemčlenný kruh je najmenej reaktívny. Tento trend je prisúdený charakteru voľného elektrónového páru – vyššia nukleofilita odpovedá vyššiemu p-charakteru orbitálu s voľným elektrónovým párom, pretože umožňuje konjugáciu s dvojitou väzbou. Analogicky platí, že ak sa voľný elektrónový pár na atóme dusíka účastní stereoelektronických interakcií na aminoskupine, tento pár „vyskočí“ mimo rovinu (pyramidalizuje, podobne ako u dusíkovej inverzie) a tak nie je schopný konjugácie s vedľajšou π C-C väzbou.[17][18]
Existuje mnoho spôsobov, ako prispôsobiť reaktivitu énamínov, napríklad zmenou teploty, rozpúšťadla, množstva činidla alebo druhu elektrofilu. Zmena týchto parametrov umožňuje preferenčnú tvorbu E/Z énamínov a takisto ovplyvňuje tvorbu viac/menej substituovaných énamínov z počiatočného ketónu.[19]
Reakcie upraviť
Alkylácia upraviť
Aj keď énamíny sú nukleofilnejšie než enoly, stále reagujú selektívne, takže sú užitočné pre alkylačné reakcie. Énamínový nukleofil môže atakovať haloalkány, čím vzniká imíniová soľ, ktorá sa hydrolyzuje za vzniku ketónu (počiatočný materiál v syntéze énamínov). Priekopníkom tejto reakcie bol Gilbert Stork a niekedy sa označuje podľa neho (Storkova énamínová alkylácia). Analogicky je možné podobnú reakciu použiť i na acyláciu. V tejto reakcii možno použiť mnohé alkylačné a acylačné činidlá, vrátane benzylických a alylických halogenidov.[20]
Acylácia upraviť
V reakcii podobnej alkylácii énamínov je možné énamíny i acylovať, čím vznikajú dikarbonylové zlúčeniny. Počiatočný énamín nukleofilne atakuje acylhalogenid, čím prechodne vzniká imíniová soľ, ktorá v prítomnosti kyseliny hydrolyzuje.[21]
Metaloénamíny upraviť
Silné zásady, napríklad LiNR2, sú schopné deprotonovať imíny za vzniku metaloénamínov. Metaloénamíny sú užitočné v chemickej syntéze vďaka ich nukleofilite (sú ešte nukleofilnejšie než enoláty). Sú teda schopné lepšie reagovať so slabšími elektrofilmi (možno ich použiť na otvorenie epoxidového kruhu[22]). Tieto reakcie umožňujú asymetrickú alkyláciu ketónov, pretože v procese vznikajú chirálne metaloénamíny.[23]
Halogenácia upraviť
β-halogénimíniové zlúčeniny možno syntetizovať halogenáciou énamínov s halogenidmi v dietyléteri. Hydrolýzou z nich potom vznikajú α-halogénketóny.[24] Je možné použiť chloráciu, bromáciu a dokonca i jodáciu. Všeobecná reakcia prebieha nasledovne:
Oxidačný coupling upraviť
Énamíny reagujú s enolsilánmi v cross-couplingových reakciách s dusičnanom diamónno-ceričitým. Tieto reakcie popísala Narasakova skupina v roku 1975 a predstavujú spôsob tvorby stabilných énamínov ako i spôsob prípravy 1,4-diketónu (odvodeného od morfolínového činidla použitého pri reakcii).[25] Ich výsledky neskôr využila skupina MacMillana na vývoj organokatalyzátora, ktorý pri použití s Narasakovými substrátmi enantioselektívne produkuje 1,4-dikarbonylové zlúčeniny s dobrým výťažkom.[26] Oxidačná dimerizácia aldehydov v prítomnosti amínov prebieha cez énamínový intermediát a nakoniec vzniká pyrol.[27] Táto metóda symetrickej syntézy pyrolov bola vyvinutá v roku 2010 v Jiovej skupine a predstavuje hodnotný nový spôsob syntézy prírodných látok obsahujúcich pyrolovú skupinu.[28]
Tvorba kruhov upraviť
Chémia énamínov bola využitá i na enantioselektívnu verziu Robinsonovej anulácie. V tejto reakcii, ktorú opísal Robert Robinson v roku 1935, prebieha zásadou katalyzovaná reakcia, ktorá spája ketón a metylvinylketón (skracovaný na MVK) do cyklohexénónového kruhového systému. Túto reakciu katalyzuje napríklad prolín, čo vedie k tvorbe chirálneho énamínu, ktorý umožňuje dobrú stereoselektivitu.[29] Tá je dôležitá hlavne v niektorých oblastiach prípravy prírodných látok, napríklad pre syntézu Wielandovho-Miescherovho ketónu, ktorý je dôležitým stavebným kameňom pre komplexnejšie biologicky aktívne molekuly.[30][31]
Referencie upraviť
- ↑ a b c énamíny. In: BÍNA, Jaroslav. Malá encyklopédia chémie. Bratislava : Obzor, 1981. S. 225.
- ↑ Clayden, Jonathan. Organic chemistry. Oxford, Oxfordshire : Oxford University Press, 2001. Dostupné online. ISBN 978-0-19-850346-0.
- ↑ SMITH, Michael, October 17-. March's advanced organic chemistry : reactions, mechanisms, and structure.. Hoboken, N.J. : Wiley-Interscience, 2007. (6th ed..) Dostupné online. ISBN 0-471-72091-7.
- ↑ Enamines: Synthesis: Structure, and Reactions, Second Edition, Gilbert Cook (Editor). 1988, Marcel Dekker, NY. ISBN 0-8247-7764-6
- ↑ 2,2-(TRIMETHYLENEDITHIO)CYCLOHEXANONE [online]. www.orgsyn.org, [cit. 2023-04-09]. Dostupné online. (po anglicky)
- ↑ CYCLODECANONE [online]. www.orgsyn.org, [cit. 2023-04-09]. Dostupné online. (po anglicky)
- ↑ Imines and Enamines | PharmaXChange.info
- ↑ The Enamine Alkylation and Acylation of Carbonyl Compounds. Journal of the American Chemical Society, 1963, s. 207–222. Dostupné online. ISSN 0002-7863. DOI: 10.1021/ja00885a021. (po anglicky)
- ↑ Über einfache Enamine mit tertiär gebundenem Stickstoff. Berichte der Deutschen Chemischen Gesellschaft (A and B Series), 1936, s. 2106–2112. Dostupné online. ISSN 0365-9488. DOI: 10.1002/cber.19360690921. (po nemecky)
- ↑ Comparison of the tautomerization and hydrolysis of some secondary and tertiary enamines. The Journal of Organic Chemistry, April 1990, s. 2317–2324. DOI: 10.1021/jo00295a017.
- ↑ Stoichiometric Enamine Chemistry [online]. Baran Group, The Scripps Research Institute. Dostupné online.
- ↑ Enamine Reactions [online]. UC Davis Chem Wiki, 2013-10-16. Dostupné online.
- ↑ Improved Titanium Tetrachloride Procedure for Enamine Synthesis. Acta Chemica Scandinavica, 1984, s. 49–53. DOI: 10.3891/acta.chem.scand.38b-0049.
- ↑ A versatile new enamine synthesis. The Journal of Organic Chemistry, January 1967, s. 213–214. DOI: 10.1021/jo01277a052.
- ↑ Stoichiometric Enamine Chemistry [online]. Baran Group, The Scripps Research Institute. Dostupné online.
- ↑ Enamines: Recent advances in synthetic, spectroscopic, mechanistic, and stereochemical aspects—II. Tetrahedron, May 1982, s. 3363–3446. DOI: 10.1016/0040-4020(82)85027-8.
- ↑ Structure-Nucleophilicity Relationships for Enamines. Chem. Eur. J., 2003, s. 2209–18. DOI: 10.1002/chem.200204666. PMID 12772295.
- ↑ Enamines: Recent advances in synthetic, spectroscopic, mechanistic, and stereochemical aspects—II. Tetrahedron, May 1982, s. 3363–3446. DOI: 10.1016/0040-4020(82)85027-8.
- ↑ Stoichiometric Enamine Chemistry [online]. Baran Group, The Scripps Research Institute. Dostupné online.
- ↑ WADE, L.G.. Organic Chemistry. Saddle River, NJ : Prentice Hall, 1999. Dostupné online. ISBN 9780139227417. S. 1019.
- ↑ Enamine Reactions [online]. UC Davis Chem Wiki, 2013-10-16. Dostupné online.
- ↑ Enolates and Metalloenamines II [online]. . Dostupné online. [nefunkčný odkaz]
- ↑ Asymmetric alkylation of acyclic ketones via chiral metallo enamines. Effect of kinetic vs. thermodynamic metalations.. The Journal of Organic Chemistry, August 1978, s. 3245–3247. DOI: 10.1021/jo00410a034.
- ↑ Zur Halogenierung von Enaminen — Darstellung von β-Halogen-iminium-halogeniden. Chemische Berichte, 1979, s. 1670–1676. DOI: 10.1002/cber.19791120517.
- ↑ Synthesis of 1,4-diketones by the reaction of silyl enol ether with silver oxide. Regiospecific formation of silver(I) enolate intermediates. Journal of the American Chemical Society, 1975, s. 649–651. DOI: 10.1021/ja00836a034.
- ↑ Enantioselective organocatalytic singly occupied molecular orbital activation: the enantioselective alpha-enolation of aldehydes.. J. Am. Chem. Soc., 2007, s. 7004–7005. Dostupné online. DOI: 10.1021/ja0719428. PMID 17497866.
- ↑ One-pot AgOAc-mediated synthesis of polysubstituted pyrroles from primary amines and aldehydes: application to the total synthesis of purpurone. Organic Letters, 2010, s. 4066–4069. DOI: 10.1021/ol101644g. PMID 20734981.
- ↑ Oxidative Coupling of Enolates, Enol Silanes, and Enamines: Methods and Natural Product Synthesis. European Journal of Organic Chemistry, September 2012, s. 4881–4896. DOI: 10.1002/ejoc.201200665. PMID 23471479.
- ↑ Proline-catalyzed asymmetric reactions. Tetrahedron, 2002, s. 5573–5590. DOI: 10.1016/s0040-4020(02)00516-1.
- ↑ A proline-catalyzed asymmetric Robinson Annulation. Tetrahedron Letters, 2000, s. 6951–6954. DOI: 10.1016/s0040-4039(00)01180-1.
- ↑ Enantioselective Organic Catalysis:Non-MacMillan Approaches [online]. . Dostupné online. Archivované 2017-10-26 z originálu.
Pozri aj upraviť
Zdroj upraviť
Tento článok je čiastočný alebo úplný preklad článku Enamine na anglickej Wikipédii.