Acylhalogenid
Acylhalogenid je funkčný derivát karboxylovej kyseliny. Sú to zlúčeniny, ktoré sú odvodené od oxokyselín[1] (v organickej chémii zvyčajne karboxylových kyselín) nahradením hydroxylovej skupiny za halogenid.[2]
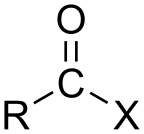
Ak je oxokyselinou kyselina karboxylová, tak acylhalogenidy obsahujú funkčnú skupinu –COX, ktorá sa skladá z karbonylovej skupiny viazanej jednoduchou väzbou na halogén.[3] Všeobecný vzorec acylhalogenidov je RCOX, kde R je napríklad alkylová skupina, CO je karbonylová skupina a X je halogenid, napríklad chlorid. Acylchloridy sú najbežnejšie acylhalogenidy, ale v najväčšej miere sa spomedzi acylhalogenidov (prechodne) produkuje acetyljodid. Ročne sa ho vyrábajú miliardy kilogramov pri výrobe kyseliny octovej.[4]
Príprava
upraviťAlifatické acylhalogenidy
upraviťV priemyselnom merítku tvorí reakcia anhydridu kyseliny octovej s chlorovodíkom zmes acetylchloridu a kyseliny octovej:[5]
- (CH3CO)2O + HCl → CH3COCl + CH3CO2H
Bežné syntézy acylchloridov takisto využívajú reakcie karboxylových kyselín s fosgénom, tionylchloridom[6] a chloridom fosforitým.[7] Bromid fosforečný sa používa na tvorbu acylbromidov, ktoré sú však málokedy hodnotné.
Aromatické acylchloridy
upraviťBenzoylchlorid vzniká z benzotrichloridu v reakcii s vodou alebo kyselinou benzoovou:[8]
- C6H5CCl3 + H2O → C6H5COCl + 2 HCl
- C6H5CCl3 + C6H5CO2H → 2 C6H5COCl + HCl
Podobne ako u iných acylchloridov je možné ho vytvoriť z kyseliny pôsobením chloračných činidiel chloridu fosforečného alebo tionylchloridu.
Reprezentatívne laboratórne prípravy aromatických acylhalogenidov sú porovnateľné s prípravami alifatických acylhalogenidov.[9] Je možné využiť napríklad chlóroformyláciu, čo je konkrétny druh Friedel-Craftsovej acylácie, ktorá využíva formaldehyd ako reaktant,[chýba zdroj] alebo priamu chloráciu benzaldehydových derivátov.[10]
Acylfluoridy
upraviťAcylchloridy reagujú s fluorovodíkom za vzniku acylfluoridov.[11] Aromatické (i alifatické) acylfluoridy sú bežne pripravované priamo z karboxylových kyselín s použitím stabilných lacných chemikálií: PPh3, NBS a Et3N-3HF.[12] Kyanurátfluorid premieňa karboxylové kyseliny na acylfluoridy.
Acylbromidy a acyljodidy
upraviťAcylbromidy a acyljodidy sa syntetizujú obdobnými reakciami, ale sú menej bežné.[13]
Reakcie
upraviťAcylhalogenidy sú relatívne reaktívne zlúčeniny, ktoré sú často syntetizované na priame použitie v syntéze iných organických zlúčenín. Acylhalogenidy reagujú napríklad s:
- vodou, čím vznikajú karboxylové kyseliny. Táto hydrolýza je najbežnejšie využívaná reakcia acylhalogenidov, keďže sa využíva pri priemyselnej príprave kyseliny octovej.
- aromatickými zlúčeninami, s použitím Lewisovej kyselina ako katalyzátoru, napríklad AlCl3, čím vznikajú aromatické ketóny. Jeden z bežných procesov je Friedel-Craftsova acylácia.
- karboxylovými kyselina, čím vznikajú anhydridy organických kyselín.[14]
V reakciách vyššie vzniká HX (halogenovodík). Ak sa použije napríklad acylchlorid, v procese vyzniká chlorovodík.
Viac funkčných skupín
upraviťMolekula môže mať viac než jednu acylhalogenidovú funkčnú skupinu. Napríklad adipoyldichlorid, zvyčajne nazývanú len adipoylchlorid, má dve acylchloridové funkčné skupiny. Je to dichlorid šesťuhlíkovej dikarboxylovej kyseliny adipovej. Jeho dôležitým použitím je polymerizácia s organickými diamino zlúčeninami, čím vzniká polyamid zvaný nylon. Polymerizáciou s niektorými inými organickými zlúčeninami vznikajú polyestery.
Fosgén (karbonyldichlorid, Cl–CO–Cl) je veľmi toxický plyn. Je to dichlorid kyseliny uhličitej. Oba chloridové radikály z fosgénu môžu podstupovať reakcie podobné acylhalogenidom. Fosgén sa používa ako reaktant v príprave polykarbonátových polymérov, popri iných využitiach.
Všeobecné riziká
upraviťPrchavé acylhalogenidy spôsobujú slzenie, pretože reagujú s vodou na povrchu očí, čím vznikajú halogénovodíkové a organické kyseliny, ktoré dráždia oči. Podobný problém môže vzniknúť pri vdýchnutí výparov acylhalogenidov. Všeobecne sú acylhalogenidy (i neprchavé, ako je tozylchlorid) dráždivé pre oči, pokožku a sliznice.
Referencie
upraviť- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "acyl groups". DOI:10.1351/goldbook.A00123
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "acyl halides". DOI:10.1351/goldbook.A00124
- ↑ Acyl Halides. Ed. Saul Patai. [s.l.] : [s.n.], 1972. ISBN 9780470771273. DOI:10.1002/9780470771273
- ↑ Hosea Cheung, Robin S. Tanke, G. Paul Torrence "Acetic Acid" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a01_045
- ↑ CHEUNG, Hosea; TANKE, Robin S.; TORRENCE, G. Paul. Acetic Acid. Weinheim, Germany : Wiley-VCH Verlag GmbH & Co. KGaA, 2000-06-15. DOI: 10.1002/14356007.a01_045. Dostupné online. ISBN 978-3-527-30673-2. DOI:10.1002/14356007.a01_045 S. a01_045. (po anglicky)
- ↑ n-Butyrl chloride. Organic Syntheses, 1929, s. 32. DOI: 10.15227/orgsyn.009.0032.
- ↑ Desoxybenzoin. Organic Syntheses, 1932, s. 16. DOI: 10.15227/orgsyn.012.0016.
- ↑ MAKI, Takao; TAKEDA, Kazuo. Benzoic Acid and Derivatives. Weinheim, Germany : Wiley-VCH Verlag GmbH & Co. KGaA, 2000-06-15. DOI: 10.1002/14356007.a03_555. Dostupné online. ISBN 978-3-527-30673-2. DOI:10.1002/14356007.a03_555 S. a03_555. (po anglicky)
- ↑ p-Nitrobenzoyl chloride. Organic Syntheses, 1923, s. 75. DOI: 10.15227/orgsyn.003.0075.
- ↑ o-Chlorobenzoyl chloride. Organic Syntheses, 1929, s. 34. DOI: 10.15227/orgsyn.009.0034.
- ↑ Preparation of Acyl Fluorides with Anhydrous Hydrogen Fluoride. The General Use of the Method of Colson and Fredenhagen. J. Org. Chem., 1961, s. 237–238. DOI: 10.1021/jo01060a600.
- ↑ Direct Access to Acyl Fluorides from Carboxylic Acids Using a Phosphine/Fluoride Deoxyfluorination Reagent System. Organic Letters, 2019-03-15, s. 1659–1663. Dostupné online. ISSN 1523-7060. DOI: 10.1021/acs.orglett.9b00197. PMID 30840474.
- ↑ Diiodosilane. 3. Direct synthesis of acyl iodides from carboxylic acids, esters, lactones, acyl chlorides and anhydrides. The Journal of Organic Chemistry, June 1990, s. 3922–3926. Dostupné online. ISSN 0022-3263. DOI: 10.1021/jo00299a042. (po anglicky)
- ↑ Acid Anhydrides. Organic Syntheses, 1946, s. 1. DOI: 10.15227/orgsyn.026.0001.
Zdroj
upraviťTento článok je čiastočný alebo úplný preklad článku Acyl halide na anglickej Wikipédii.