Hydrogénuhličitan
Hydrogénuhličitan[1] alebo hydrogenuhličitan[1][2] (staršie hydrouhličitan[1], v lekárstve občas bikarbonát) je jeden z aniónov kyseliny uhličitej. Tento anorganický anión vzniká deprotonáciou kyseliny uhličitej. Je to polyatómový anión, ktorého vzorec je HCO3-. Soli obsahujúce tento anión sa označujú ako hydrogénuhličitany.
| Hydrogénuhličitan | |
 | |
 | |
| Všeobecné vlastnosti | |
| Sumárny vzorec | HCO3- |
| Fyzikálne vlastnosti | |
| Molárna hmotnosť | 61,0168 g/mol |
| Ďalšie informácie | |
| Číslo CAS | 71-52-3 |
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |
Hydrogénuhličitan má dôležitú biochemickú úlohu ako fyziologický tlmivý roztok.[3]
Chemické vlastnosti
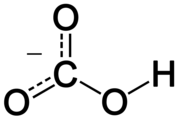
upraviťHydrogénuhličitanový anión sa skladá z jedného atómu uhlíka, na ktorý sú naviazané tri kyslíkové atómy v trigonálne planárnom usporiadaní. Na jeden z týchto kyslíkov je naviazaný vodíkový atóm. Tento anión je izoelektronický s kyselinou dusičnou, HNO3. Formálny náboj hydrogénuhličitanového aniónu je mínus jedna a je amfiprotický, takže má kyslé i zásadité vlastnosti. Je to konjugovaná zásada kyseliny uhličitej a zároveň konjugovaná kyselina uhličitanového aniónu, čo vyjadrujú nasledujúce rovnovážne rovnice:[chýba zdroj]
- H2CO3 + 2 H2O ↔ HCO3- + H3O+ + H2O ↔ CO32- + 2 H3O+
- CO32- + 2 H2O ↔ HCO3- + H2O + OH− ↔ H2CO3 + 2 OH−
Soli hydrogénuhličitanu vznikajú spojením kladne nabitého iónu na záporne nabitý kyslíkový atóm tohto iónu, čim vzniká iónová zlúčenina. Mnohé hydrogénuhličitany sú rozpustné vo vode pri štandardnej teplote a tlaku. Hydrogénuhličitan sodný prispieva k množstvu rozpustených minerálov vo vode, čo je bežný parameter pre meranie kvality vody.[4]
Fyziologický význam
upraviťHydrogénuhličitan je dôležitou zložkou tlmivého roztoku ľudského tela,[3] vďaka čomu sa udržiava acidobázická homeostáza (približne konštantné pH). Celkom 70 až 75 % oxidu uhličitého v tele sa premení na kyselinu uhličitú (H2CO3), konjugovanú kyselinu HCO3-, na ktorý sa môže rýchlo premeniť.
Hydrogénuhličitan, voda, vodíkové ióny a oxid uhličitý tvoria tlmivý roztok, pričom kyselina uhličitá pôsobí ako reakčný intermediát. Tento tlmivý roztok sa udržiava pri nestálej rovnováhe[3] a poskytuje rýchlu odpoveď a obranu na zmenu pH smerom ku kyslému i zásaditému prostrediu. To je veľmi dôležité hlavne pri ochrane tkanív centrálnej nervovej sústavy, kde zmena pH výrazne mimo normálneho rozsahu môže mať katastrofálne následky (pozri acidóza a alkalóza).
Hydrogénuhličitan je naviac dôležitý v tráviacom trakte. Zvyšuje vnútorné pH žalúdka po tom, čo veľmi kyslé žalúdočné šťavy dokončili trávenie potravy. Hydrogénuhličitan takisto reguluje pH v tenkom čreve. Vylučuje sa z pankreasu v reakcii na hormón sekretín a neutralizuje kyslú tráveninu vystupujúcu zo žalúdku do dvanástnika.[5]
Hydrogénuhličitan v prostredí
upraviťHydrogénuhličitan je hlavnou formou rozpusteného anorganického uhlíka v slanej vode[6] a väčšine sladkých vôd. Kvôli tomu je dôležitý v cykle uhlíka.
V sladkovodnej ekológii sa následkom silnej fotosyntetickej aktivity sladkovodných rastlín cez deň vylučuje plynný kyslík do vody a zároveň s tým vznikajú hydrogénuhličitanové anióny. Kvôli tomu dochádza k zvýšeniu pH, až kým sa v konkrétnych prípadoch táto zásaditosť nestane toxickou pre niektoré organizmy alebo sa kvôli tomu nestanú iné látky toxickými, napríklad amoniak. V tme, keď fotosyntéza neprebieha, dochádza k vzniku oxidu uhličitého respiračnými procesmi, takže nevznikajú nové ióny hydrogénuhličitanu a pH rýchlo klesá.[chýba zdroj]
Použitie v potravinárstve
upraviťNajbežnejšou soľou s hydrogénuhličitanovým aniónom je hydrogénuhličitan sodný, NaHCO3, ktorý je bežné známy ako sóda bikarbóna. Keď sa zahreje alebo vystaví kyseline, napríklad kyseline octovej (ktorá je prítomná v octe), hydrogénuhličitanový anión sa rozkladá a vzniká z neho oxid uhličitý. Preto sa používa ako kypriaca látka do pečenia.[7]
Hydrogénuhličitan amónny sa používa pri výrobe sušienok na trávenie.[chýba zdroj]
Diagnostika
upraviťV diagnostickej medicíne je hladina hydrogénuhličitanu v krvi jedným zo sledovaných parametrov, ktoré naznačujú acidobázickú rovnováhu v tele. Meria sa spolu s oxidom uhličitým, chloridmi, draslíkom a sodíkom, čím sa zisťuje hladina elektrolytov v krvi.[8] Nerovnováha môže poukazovať na acidózu alebo alkalózu.
Zlúčeniny s hydrogénuhličitanovým aniónom
upraviťMedzi hydrogénuhličitany patria napríklad:
Referencie
upraviť- ↑ a b c hydrogénuhličitan | Jazyková poradňa | SME.sk [online]. jazykovaporadna.sme.sk, [cit. 2022-04-30]. Dostupné online.
- ↑ hydrogenuhličitany. In: Encyclopaedia Beliana. 1. vyd. Bratislava : Encyklopedický ústav SAV; Veda, 2010. 686 s. ISBN 978-80-970350-0-6. Zväzok 6. (His – Im), s. 369.
- ↑ a b c Clinical correlates of pH levels: bicarbonate as a buffer [online]. Biology.arizona.edu, October 2006. Dostupné online. Archivované 2015-05-31 z originálu.
- ↑ GEOR, Raymond J.; COENEN, Manfred; HARRIS, Pat. Equine Applied and Clinical Nutrition: Health, Welfare and Performance. [s.l.] : Elsevier Health Sciences, 31 January 2013. ISBN 978-0-7020-5418-1. S. 90. (po anglicky)
- ↑ Berne & Levy, Principles of Physiology
- ↑ The chemistry of ocean acidification : OCB-OA [online]. Woods Hole Oceanographic Institution, 24 September 2012. Dostupné online. Archivované 2017-05-19 z originálu. (po anglicky)
- ↑ Jaký je rozdíl mezi práškem do pečiva a jedlou sodou? [online]. 2018-05-03, [cit. 2022-04-30]. Dostupné online. (po česky)
- ↑ Acid Base Balance (page 3) Archivované 2002-06-13 na Wayback Machine
Zdroj
upraviťTento článok je čiastočný alebo úplný preklad článku Bicarbonate na anglickej Wikipédii.