Purín
Purín je aromatická heterocyklická organická zlúčenina zložená z pyrimidínového a imidazolového jadra. Puríny, vrátane substitouvaných purínov a tautomérov, patria k najbežnejším dusíkatým heterocyklom v prírode. Puríny a pyrimidíny vytvárajú 2 skupiny dusíkatých báz. Dve zo štyroch deoxyribonukleových báz a dve zo štyroch ribonukleových báz sú puríny. Sú to adenín a guanín.[1]
| Purín | |
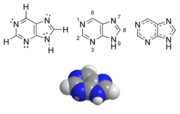 | |
 | |
| Všeobecné vlastnosti | |
| Sumárny vzorec | C5H4N4 |
| Synonymá | 9H-purín |
| Fyzikálne vlastnosti | |
| Molárna hmotnosť | 120,11 g/mol |
| Teplota topenia | 214 °C |
| Ďalšie informácie | |
| Číslo CAS | 120-73-0 |
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |
Dôležité puríny
upraviťV prírode sa nachádza mnoho purínov. Dve dusíkaté bázy sú puríny adenín a guanín. Iné dôležité puríny sú hypoxantín, xantín, teobromín, kofeín, kyselina močová a izoguanín.
Funkcia
upraviťOkrem hlavnej úlohy purínov pri stavbe DNA a RNA sú puríny tiež zložkou mnohých dôležitých biomolekúl, ako sú napríklad ATP, GTP, cyklický AMP, NADH alebo koenzým A. Purín samotný sa dosiaľ v prírode nenašiel, ale je ho možné laboratórne syntetizovať.
Puríny tiež môžu mať funkciu neurotransmiterov (látok schopných prenášať informáciu medzi neurónmi) pracujúcich na princípe purínergických receptorov. Adenozín aktivuje adenozínové receptory.
História
upraviťPomenovanie "purín" (purum uricum) zaviedol nemecký chemik Emil Fischer v roku 1884. Dokázal ho poprvýkrát syntetizovať v roku 1899. Ako východiskovú látku použil kyselinu močovú, ktorá bola po prvý raz izolovaná z obličkových kameňov Scheeleom v roku 1776. Potom ju nechal zreagovať s chloridom fosforečným za vzniku 2,6,8-trichlóropurínu, ktorý bol následne premenený jodovodíkom a fosfónium jodidom na 2,6-dijódopurín. Potom následnej redukcii zinkovým práškom vznikol purín.[2][3]
Metabolizmus
upraviťMnoho organizmov má metabolické dráhy schopné syntetizovať alebo rozložiť puríny. Sú prírodne syntetizované ako nukleotidy. Až 90% purínov sa v rámci organizmu recykluje, pretože ich syntéza je energeticky veľmi náročná.
Zdroje purínov
upraviťPuríny sa nachádzajú vo vysokých koncentráciách v mäse, v niektorých vnútorných orgánoch, v ančovičkách, v herringoch, makrelách alebo v pive. Vegetariánska strava je chudobná na puríny.[4][5]
Syntéza
upraviťOkrem syntézy in vivo je možná aj umelá syntéza. Purín sa dá získať s dobrým výnosom (asi 71%) zahrievaním formamidu:
Táto pozoruhodná reakcia sa preberá v teórii o vzniku života na Zemi.
Ďalšia možná schéma: formamid sa zahreje v otvorenej nádobe zhruba na 28 hodín v olejovom kúpeli na 170-190 °C. Po oddestilovaní zvyšného formamidu sa urobí reflux metanolom. Nasleduje filtrácia, potom destilácia a produktom je takmer čistý purín.[6]
Zdroje
upraviť- ↑ Rosemeyer, H. Chemistry & Biodiversity 2004, 1, 361.
- ↑ Fischer, E. Berichte der Deutschen Chemischen Gesellschaft 1899, 32, 2550.
- ↑ Scheele, V. Q. Examen Chemicum Calculi Urinari, Opuscula, 1776, 2, 73.
- ↑ Archivovaná kópia [online]. [Cit. 2012-06-15]. Dostupné online. Archivované 2011-11-12 z originálu.
- ↑ Gout Diet: Limit High Purine Foods
- ↑ Yamada, H.; Okamoto, T.. A One-step Synthesis of Purine Ring from Formamide. Chemical & Pharmaceutical Bulletin, 1972, s. 623. Dostupné online. DOI: 10.1248/cpb.20.623.