Oxid chloričitý
Oxid chloričitý je anorganická zlúčenina kyslíku a chlóru. Za normálnych podmienok sa ide o žlto-zelený ostro štipľavo zapáchajúci plyn. Tuhne pri -59 °C, kedy vytvára jasnooranžové kryštály. Pri vyšších koncentráciách je v plynnom skupenstve nestabilný a rozkladá sa. Využíva sa ako oxidovadlo, na bielenie, pri úprave vody a pri dezinfekcii. Takisto sa využíva v potravinárstve pod označením E 926.
| Oxid chloričitý | |||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||
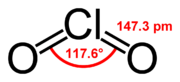
| Sumárny vzorec | ClO2 | ||||||||||||||||||||||||||||||
| Systematický názov | oxid chloričitý | ||||||||||||||||||||||||||||||
| Synonymá | E 926 | ||||||||||||||||||||||||||||||
| Vzhľad | žlto-zelený plyn | ||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||
| Molárna hmotnosť | 67,45 g·mol−1 | ||||||||||||||||||||||||||||||
| Teplota topenia | −59 °C | ||||||||||||||||||||||||||||||
| Teplota varu | 11 °C | ||||||||||||||||||||||||||||||
| Hustota | 2,757 g/dm3 | ||||||||||||||||||||||||||||||
| Rozpustnosť | 8 g/dm3 vo vode pri 20 °C rozpustný aj vo vodných roztokoch minerálnych kyselín | ||||||||||||||||||||||||||||||
| Termochemické vlastnosti | |||||||||||||||||||||||||||||||
| Štandardná zlučovacia entalpia | 104,60 kJ/mol | ||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||
| Číslo CAS | 10049-04-4 | ||||||||||||||||||||||||||||||
| Číslo UN | 9191 | ||||||||||||||||||||||||||||||
| EINECS číslo | 233-162-8 | ||||||||||||||||||||||||||||||
| Číslo RTECS | FO3000000 | ||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||
Príprava
upraviťKvôli jeho nestabilite sa väčšinou uprednostňujú spôsoby kde oxid chloričitý vzniká rozpustený v roztoku.
Oxidáciou chloritanov
upraviťOxid chloričitý môžeme v laboratóriu pripraviť chloritanu sodného pomocou chlóru:[1]
Okrem toho sa dá pripraviť aj reakciou s chloritanu sodného s kyselinou chlorovodíkovou:
- 5 NaClO2 + 4 HCl → 5 NaCl + 4 ClO2 + 2 H2O
Pri použití aj tretieho reaktantu - chlórnanu sodného je spotreba kyseliny chlorovodíkovej nižšia:
- 2 NaClO2 + 2 HCl + NaClO → 2 ClO2 + 3 NaCl + H2O
Redukciou chlorečnanov
upraviťV laboratóriu výrobe sa zväčša na výrobu z chlorečnanov používa reakcia medzi chlorečnanom draselným s kyselinou šťaveľovou:
- 2 KClO3 + 2 H2C2O4 → K2C2O4 + 2 ClO2 + 2 CO2 + H2O
Niekedy aj za prítomnosti kyseliny sírovej:
- 2 KClO3 + H2C2O4 + 2 H2SO4 → 2 KHSO4 + 2 ClO2 + 2 CO2 + 2 H2O
Priemyselne sa približne 95 % oxidu chloričitého pripravuje pomcou redukcie chlorečnanu sodného. Ako redukovadlo sa v takomto prípade používajú látky ako kyselina chlorovodíková, peroxid vodíka, metanol a oxid siričitý.[2] Moderné spôsoby priemyselnej výroby využívajú najmä metanol a peroxid vodíka, pretože pri použití týchto reaktantov nevzniká nežiadúci vedlajší produkt - chlór a takéto spôsoby výroby sú ekonomicky najvýhodnejšie.
Využitie
upraviťBielenie
upraviťOxid chloričitý sa používa na bielenie buničiny pri výrobe papieru z dreva niekedy aj v kombinácii s chlórom. Používaním oxidu chloričitého sa minimalizuje množstvo použitých organických chlórovaných zlúčenín pri výrobe papieru. Okolo 95 % bielenej kraftovej buničiny sa bieli pomocou oxidu chloričitého.[3]
Dezinfekcia
upraviťPoužíva sa aj na dezinfekciu zdravotných nástrojov.
Okrem medicínskeho prostredia sa používa aj na zaplynenie dozretého ovocia, ako napríklad maliny, jahody a čučoriedky, na ochranu pred plesňami a kvasinkami,[4] v EÚ je však jeho používanie zakázané.[5]
Úprava vody
upraviťOxid chloričitý sa v čističkách vôd používa na úpravu pitnej vody. Používa sa pred úpravou vody chlórom, pretože zničí organické nečistoty vo vode z ktorých by pôsobením chlóru mohli vzniknúť halogénderiváty[6], ktoré sú v pitnej vode považované za karcinogénne. Oxid chloričitý je taktiež efektívnejší než chlór na zneškodnenie baktérií z rodu legionella[7]
Chemická stabilita
upraviťPri parciálnom tlaku plynného oxidu chloričitého vyššom než 10 kPa[2], t.j. koncentrácii vyššej než 10 % vo vzduchu pri normálnych podmienkach hrozí riziko rozkladu na kyslík a chlór, ktorý je sprevádzaný výbuchom. Spúšťačom rozkladu môže byť svetlo, teplo, náhlym zvýšením okolitého tlaku. Preto sa s ním skoro nikdy nepracuje vo forme koncentrovaného plynu, ale vo forme roztoku v koncentráciách 0,5 - 10 g/dm3.
Referencie
upraviť- ↑ Chlorine(IV) Oxide Inorganic Syntheses (po anglicky)
- ↑ a b Chlorine Oxides and Chlorine Oxygen Acids Ullmann's Encyclopedia of Industrial Chemistry (po anglicky)
- ↑ Trends in World Bleached Chemical Pulp Production: 1990-2005 Aliance for Environmental Technology (po anglicky, archivované na Wayback Machine)
- ↑ Chlorine Dioxide Pouches Can Make Produce Safer and Reduce Spoilage (po anglicky)
- ↑ E926 - Oxid chloričitý Fér potravina (po česky)
- ↑ Trihalomethane formation during chemical oxidation with chlorine, chlorine dioxide and ozone of ten Italian natural waters (po anglicky)
- ↑ Safety and Efficacy of Chlorine Dioxide for Legionella Control in a Hospital Water System Cambridge University Press (po anglicky)




